修回日期: 2009-10-09
接受日期: 2009-10-12
在线出版日期: 2009-10-28
目的: 检测胃癌组织中RASSF1A基因启动子区甲基化状况, 并探讨其与临床病理特征的关系.
方法: 采用甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)检测39例胃癌组织, 及相应癌旁组织和30例对照组织中RASSF1A基因启动子区甲基化水平.
结果: 胃癌组织中RASSF1A基因启动子区甲基化率显著高于癌旁组织甲基化率及对照组(64.1% vs 7.7%, 0%, 均P<0.01). 胃癌组织中不同年龄、性别、分化程度及淋巴结转移与否的RASSF1A基因甲基化率的差异均无统计学意义.
结论: RASSF1A基因启动子区甲基化与胃癌的发生密切相关, MSP法是一种快速、敏感的基因甲基化检测方法, 可用于胃癌的辅助诊断.
引文著录: 刘培, 姜相君, 葛银林. RASSF1A基因启动子区甲基化在胃癌组织中的检测. 世界华人消化杂志 2009; 17(30): 3144-3147
Revised: October 9, 2009
Accepted: October 12, 2009
Published online: October 28, 2009
AIM: To detect RAS association domain family protein 1A (RASSF1A) promoter methylation and analyze its correlation with clinical and pathological parameters in gastric cancer.
METHODS: Methylation-specific polymerase chain reaction (MSP) was used to detect RASSF1A promoter methylation in tumor and tumor-adjacent tissues from 39 gastric cancer patients and in 30 control specimens from superficial gastritis patients or healthy volunteers.
RESULTS: The rate of RASSF1A promoter methylation was significantly higher in gastric cancer than in tumor-adjacent tissues and control specimens (64.1% vs 7.7% and 0%, respectively; both P < 0.01). No correlation was found between RASSF1A promoter methylation and age, gender, tumor differentiation or lymph node metastasis in patients with gastric cancer.
CONCLUSION: RASSF1A promoter methylation is closely associated with the oncogenesis of gastric cancer. MSP is a novel and specific method for detection of promoter region methylation and can be used to diagnose gastric carcinoma.
- Citation: Liu P, Jiang XJ, Ge YL. Detection of RASSF1A promoter methylation in gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3144-3147
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3144.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3144
近年越来越多的研究显示, 抑癌基因启动子区高甲基化导致其转录抑制、表达缺失, 而且在肿瘤临床确诊之前就可检测出特异基因的甲基化异常现象, 为肿瘤的早期诊断提供了新的思路[1]. Ras相关区域家族1A(ras-association domain family 1A, RASSF1A)基因是近年发现的新型抑癌基因. 研究提示, 该基因启动子区高甲基化造成的失活在多种肿瘤中很常见[2]. 我们采用MSP检测胃癌组织、相应癌旁组织及对照组织中RASSF1A基因启动子区甲基化水平, 探索RASSF1A 基因启动子区甲基化与胃癌发生、发展的关系.
所有标本取自2008-12/2009-05青岛市市立医院, 其中39例胃癌及相应癌旁组织取自普外科手术切除标本(癌旁组织取自距癌边缘5 cm), 30例对照组织(其中慢性浅表性胃炎组织18例及正常胃黏膜组织12例)取自门诊胃镜室. 所有标本自取材后立即放入液氮中, 后转入-70℃冰箱保存. 癌组织, 癌旁组织和胃镜活检组织都经病理检查, 并确认手术标本切缘为阴性.
1.2.1 DNA提取: 酚/氯仿法提取DNA, 测A260/A280比值为1.8-2.0, 存于-20℃冰箱保存备用.
1.2.2 DNA修饰: 采用Zymo Research公司EZ DNA甲基化试剂盒-Gold(D5005), 按说明书步骤进行操作.
1.2.3 引物设计: 根据RASSF1A基因组DNA启动子区CpG岛DNA序列设计甲基化特异性PCR引物, RASSF1A甲基化(M)和非甲基化(U)引物(表1)由TaKaRa宝生物公司合成.
| 基因 | 正义 | 反义 | 长度(bp) |
| RASSF1A(M) | GGGTTTTGCGAGAGCGCG | AACAAACGCGAACCGAACG | 166 |
| RASSF1A(U) | GGGGTTTTGTGAGAGTGTG | ACTAACAAACACAAACCAAACA | 170 |
1.2.4 MSP: PCR反应体积25 µL, 其中PerfectshotTM Taq(loading dye mix)(TaKaRa宝生物公司)12.5 µL, 引物各0.5 µL, 修饰后的DNA 2 µL, 余下的以灭菌双蒸水补齐至25 µL. 反应条件: 95℃预变性15 min, 94℃变性30 s, 64℃(甲基化)/59℃(非甲基化)退火50 s, 72℃延伸30 s, 40个循环后, 72℃延伸10 min.
1.2.5 对照设置: 以灭菌双蒸水代替DNA作为空白对照; 以健康志愿者血清DNA作为正常对照; 健康志愿者外周血淋巴细胞DNA经CpG甲基化转移酶M.SssI(New England Biolabs)处理后作为甲基化对照, 以未行甲基化处理的健康志愿者外周血淋巴细胞DNA作为非甲基化对照.
1.2.6 电泳: 取6 µL扩增产物行20 g/L琼脂糖凝胶电泳. 用UIV凝胶电泳成像及图像分析系统进行拍照和图像分析.
统计学处理 应用SPSS13.0统计软件, 组间比较采用卡方检验, P<0.05为差异有统计学意义.
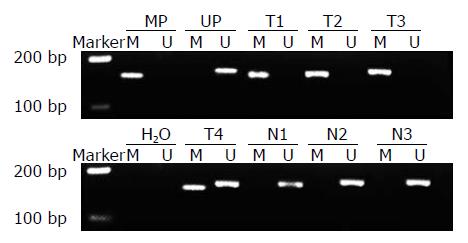
胃癌组、癌旁组及对照组RASSF1A基因启动子区CpG岛甲基化率分别为64.1%(25/39)、7.7%(3/39)和0.0%(0/30). 胃癌组的甲基化率显著高于癌旁组和对照组(均P<0.01). 其中有2例胃癌组织同时发生甲基化与非甲基化. 3例发生甲基化的癌旁组织所对应的胃癌组织均发生了甲基化(图1).
胃癌组织中不同年龄、性别、分化程度的RASSF1A基因甲基化率差异均无统计学意义. 有淋巴结转移组甲基化率(73.9%)较无淋巴结转移组甲基化率(50.0%)高, 但差别无统计学意义. 进展期胃癌和早期胃癌组织中RASSF1A基因甲基化率分别为66.7%和33.3%, 2组比较无明显差异(表2).
| 临床病理特征 | RASSF1A基因 | P值 | |
| 甲基化 | 非甲基化 | ||
| 性别 | 0.478 | ||
| 男 | 19(67.9) | 9(32.1) | |
| 女 | 6(54.5) | 5(45.5) | |
| 年龄(岁) | 0.225 | ||
| >50 | 22(68.8) | 10(31.2) | |
| ≤50 | 3(42.9) | 4(57.1) | |
| 分期 | 0.289 | ||
| Ⅰ-Ⅱ期 | 1(33.3) | 2(66.7) | |
| Ⅲ-Ⅳ期 | 24(66.7) | 12(33.3) | |
| 淋巴结转移 | 0.179 | ||
| 有 | 17(73.9) | 6(26.1) | |
| 无 | 8(50.0) | 8(50.0) | |
| 分化程度 | 0.326 | ||
| 低 | 16(72.7) | 6(27.3) | |
| 中 | 8(57.1) | 6(42.9) | |
| 高 | 1(33.3) | 2(66.7) | |
DNA甲基化是具有可逆性与遗传性的一种表观遗传学修饰方式[3], 由S-腺苷甲硫氨酸作为甲基供体, 在DNA甲基转移酶的催化下, CpG二核苷酸的胞嘧啶环5'位置的氢被活性甲基所取代, 从而转变成5-甲基胞嘧啶. 基因启动子区若发生甲基化, 可致基因转录沉寂, 表达受抑制. 研究证实DNA甲基化机制是抑癌基因失活的一个重要途径, 与肿瘤发生密切相关.
2000年Dammann et al[4]从3号染色体短臂(3p21.3)上克隆出RASSF1基因, 由于选择性剪接和启动子的不同存在不同的转录本, 其中最普遍且最重要的是转录本A(RASSF1A). RASSF1A作为一种抑癌基因, 通过多种途径抑制细胞生长、促进细胞凋亡和衰老, 其功能失活导致对肿瘤的抑制作用丧失. RASSF1A在正常组织中100%表达, 而在多种恶性肿瘤中表达明显降低或缺失, 现已明确主要机制是由于其启动子区CpG岛高甲基化[2].
甲基化特异性PCR法是一种敏感度高, 特异性强, 快速的基因甲基化检测方法. 本研究显示对照组中无1例RASSF1A基因启动子区发生甲基化, 胃癌组中该基因启动子区甲基化率(64.1%)显著高于癌旁组(7.7%)(P<0.01). Kang et al研究发现RASSF1A甲基化现象在胃癌中频繁出现, 而在其他病变(如胃腺瘤、肠上皮化生及慢性胃炎等)中出现很少[5-6]. 结合文献及本研究结果, 提示RASSF1A基因启动子区甲基化是胃癌频发的分子事件, 可能是胃癌早期发展中的一个步骤. 本研究中3例癌旁组织中RASSF1A基因发生了甲基化, 因标本来自胃癌患者, 虽经病理证实为非癌组织, 分子水平上可能并非正常, 因为表观遗传学改变的出现一般早于肿瘤的发生.
从本研究临床病理特征分析发现, 胃癌组织中不同年龄、性别、分化程度的RASSF1A基因启动子区甲基化率的差异均无统计学意义. 有淋巴结转移组甲基化率(73.9%)较无淋巴结转移组(50.0%)高, 但2组间比较也无明显差异性. 上述结果与文献研究结果一致[7]. 另分析发现进展期胃癌和早期胃癌组织中RASSF1A基因甲基化率分别为66.7%和33.3%, 两者比较无明显差异性, 而Byun et al[8]研究显示该基因缺失或异常低表达与肿瘤的分期和分级有关, 结果不一致, 可能与本研究中早期胃癌例数少有关, 需进一步探讨.
本研究显示, RASSF1A基因启动子区高甲基化与胃癌的发生密切相关, 可能是胃癌早期发展中的一个分子事件. 将RASSF1A启动子区高甲基化作为标志物, 结合其他几种甲基化率高的基因, 用甲基化特异性PCR法进行联合检测, 可为胃癌的早期诊断提供重要的理论依据和方法. 另发现, 不表达RASSF1A的肿瘤细胞株经甲基化抑制剂5-氮-2脱氧胞苷(5-aza-dC)处理后, 该基因表达恢复[9], 故抑制和逆转抑癌基因甲基化为防治肿瘤提供了新的思路, 需进一步研究.
RASSF1A是多种人类肿瘤中失活的一种抑癌基因, 研究发现其失活的主要机制是该基因启动子区的甲基化.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科
本文用甲基化特异性PCR方法检测胃癌及癌旁组织和正常对照组织中RASSF1A基因启动子区甲基化发生率, 并分析其与肿瘤临床病理特征的关系, 为胃癌的早期诊断提供方法和依据.
本研究显示, RASSF1A基因启动子区高甲基化可能是胃癌早期发展中的一个分子事件. 将RASSF1A启动子区高甲基化作为标志物, 结合其他几种甲基化率高的基因, 用甲基化特异性PCR法进行联合检测, 可为胃癌的早期诊断提供重要的理论依据和方法.
本文选题新颖, 紧密联系当前研究热点, 为临床早期诊断胃癌及治疗提供了新的思路, 可读性较好.
编辑: 李军亮 电编:何基才
| 1. | 胡 佳乐, 陈 云. RASSF1A基因甲基化作为肿瘤生物学标志的临床应用. 中国肿瘤生物治疗杂志. 2008;15:296-300. |
| 2. | Agathanggelou A, Honorio S, Macartney DP, Martinez A, Dallol A, Rader J, Fullwood P, Chauhan A, Walker R, Shaw JA. Methylation associated inactivation of RASSF1A from region 3p21.3 in lung, breast and ovarian tumours. Oncogene. 2001;20:1509-1518. [PubMed] [DOI] |
| 3. | 孙 树汉. 肿瘤的表观遗传学研究. 中国肿瘤生物治疗杂志. 2008;15:8-12. |
| 4. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21.3. Nat Genet. 2000;25:315-319. [PubMed] [DOI] |
| 5. | Kang GH, Lee S, Kim JS, Jung HY. Profile of aberrant CpG island methylation along multistep gastric carcinogenesis. Lab Invest. 2003;83:519-526. [PubMed] |
| 6. | Kang GH, Lee HJ, Hwang KS, Lee S, Kim JH, Kim JS. Aberrant CpG island hypermethylation of chronic gastritis, in relation to aging, gender, intestinal metaplasia, and chronic inflammation. Am J Pathol. 2003;163:1551-1556. [PubMed] |
| 7. | Ye M, Xia B, Guo Q, Zhou F, Zhang X. Association of diminished expression of RASSF1A with promoter methylation in primary gastric cancer from patients of central China. BMC Cancer. 2007;7:120. [PubMed] [DOI] |
| 8. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |