修回日期: 2008-09-22
接受日期: 2008-10-07
在线出版日期: 2008-10-28
目的: 研究肠上皮细胞(Caco-2)在侵袭性大肠杆菌(enteroinvasive Escherichia coli, EIEC)感染后, 紧密连接(TJ)相关蛋白表达的改变及乳酸菌对Caco-2细胞的保护作用机制.
方法: 将Caco-2感染模型分为正常组、感染组、乳酸菌处理组和庆大霉素处理组. 采用免疫金标记及电镜观察上皮细胞间TJ的位置和超微结构. 免疫荧光观察TJ相关蛋白(Claudin-1, Occludin, JAM-1, ZO-1)及F-actin的表达分布和超微结构变化.
结果: 紧密连接结构位于相邻上皮细胞间的顶端, 间隙大小约25-38 nm. EIEC感染后, 免疫胶体金定位不清, 细胞骨架F-actin遭到破坏, 相邻Caco-2细胞间TJ结构遭到破坏, TJ相关蛋白(Claudin-1蛋白, Occludin蛋白, JAM-1蛋白, ZO-1蛋白)的表达亦减少, 而乳酸菌处理后F-actin的表达明显增多, 可减轻EIEC引起的TJ结构受损, TJ相关蛋白的表达增多.
结论: EIEC感染导致Caco-2细胞细胞骨架F-actin、TJ相关蛋白的表达和分布发生改变. 乳酸菌可以明显抑制EIEC引起的单层细胞TJ结构和相关蛋白的破坏, 并改善细胞骨架的分布表达.
引文著录: 杨俊, 张中伟, 秦环龙. 乳酸菌对肠上皮细胞侵袭性大肠杆菌损伤的保护作用. 世界华人消化杂志 2008; 16(30): 3394-3399
Revised: September 22, 2008
Accepted: October 7, 2008
Published online: October 28, 2008
AIM: To investigate the alteration of intestinal epithelial tight junction proteins after infection with enteroinvasive Escherichia coli and to study mechanism underlying protective effect of Lactobacillus plantarun on Caco-2 cells.
METHODS: Caco-2 models were established and divided into normal group, infection group, Lactobacillus treatment group and gentamicin treatment group. Ultrastructure of tight junction structure was observed using immuno-gold labeling. The distribution and structure of tight junction proteins, such as Claudin-1, Occludin, ZO-1, JAM-1 as well as F-actin were examined using immunofluorescence assay.
RESULTS: The tight junction structure was at the top of intestine epithelial cells. After infection with EIEC, the structure of tight junction was destroyed and the expression of F-actin and tight junction proteins (such as Claudin-1, Occludin, JAM-1, ZO-1) were diminished. But Lactobacillus plantarun prevented the damage induced by EIEC.
CONCLUSION: The Lactobacillus plantarun exerts a protective effect against the damage to the F-actin and distribution of TJ proteins promoted by enteroinvasive Escherichia coli infection.
- Citation: Yang J, Zhang ZW, Qin HL. Protective role of Lactobacillus plantarun in regulating intestinal epithelial cells response to pathogenic bacteria. Shijie Huaren Xiaohua Zazhi 2008; 16(30): 3394-3399
- URL: https://www.wjgnet.com/1009-3079/full/v16/i30/3394.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i30.3394
肠道上皮黏膜是肠道最重要的一道屏障, 由肠上皮细胞和相邻细胞间的连接构成. 而Claudin, Occludin, JAM(junction adherensive molecular), ZOs(zonula occludins)等结构蛋白及各类连接蛋白分子共同组成的紧密连接(tight junction, TJ)是构成上皮屏障功能最重要的结构[1]. 一旦肠上皮细胞间TJ结构受损, 细胞间通透性就会增加, 毒素或微生物代谢产物由此进入体循环, 引起肠道局部感染或脓毒症等全身性反应. 因此, 阐明TJ在肠上皮屏障中所发挥的作用及其相关调控机制对深入了解肠屏障功能及防治某些疾病的发生具有重要意义[2-4].
乳酸菌LP-Onlly(Lactobacillus plantarun Onlly, 分型菌株号: CGMCC No. 1258)由上海交大昂立生物公司提供; 侵袭性大肠杆菌(enteroinvasive Escherichia coli, EIEC), 血清分型O 124: NM(ATCC 43893)由上海市疾控中心提供; Caco-2细胞购自中科院上海细胞所; DMEM(H)高糖培养基、胎牛血清(Hyclone公司, 美国); MRS培养基、LB培养基((Difco公司, 美国); 单克隆兔抗人Claudin-1、Occludin、JAM-1、ZO-1抗体, FITC标记羊抗兔二抗(Zymed公司, 美国); 抗兔IgG-胶体金, 直径5 nm(Sigma公司, 美国); Tecnai G2透射电子显微镜(FEI公司); Leica TCS SP2激光共聚焦显微镜(Leica, 德国).
1.2.1 细菌培养及计数: 新鲜配置并高压灭菌MRS和LB培养液. 将乳酸菌LP-Onlly和EIEC分别接种于MRS和LB培养液中, 37℃下摇床培养16 h至生长平台期. 待其成为混浊液后进行细菌计数(比浊法). 将菌液1500 r/min离心5 min, 倒去液体, 用无菌PBS稀释, 光电比色计测定菌液浓度, 调整浓度为1×1011/L.
1.2.2 细胞的培养: DMEM高糖液体培养基, 另加100 mL/L胎牛血清, 1×105 U/L青霉素, 100 mg/L链霉素. 在50 mL/L CO2饱和湿度37℃条件下培养, 当细胞生长至80%-90%融合时, 用2.5 g/L胰酶+0.3 g/L EDTA液消化细胞, 按1:3传代培养, 实验所用细胞在10代以内. 将细胞接种于六孔细胞培养板内经明胶处理无菌玻片及Millicell插入式培养皿, 细胞浓度为5×104/cm2, 生长7-10 d至细胞成单层后进行实验.
1.2.3 实验分组及处理: 实验分为4组, 即正常组、感染组、乳酸菌处理组、庆大霉素处理组. 感染组: 当细胞生长融合形成单层细胞后, 按50:1的比例加入EIEC细菌培养; 乳酸菌处理组: 将计数后的乳酸菌按100:1的比例加入六孔板细胞中, 37℃条件下孵育1 h, 再加入EIEC感染; 庆大霉素组: 感染3 h后, 加入庆大霉素(50 mg/L). 分别在实验开始后的3、6、12、24 h取样.
1.2.4 透射电镜下观察TJ超微结构: 取Millicell插入式培养皿培养的单层培养细胞, 用25 g/L戊二醛固定2 h, 连膜一起切下, 常温下包埋后进行半薄切片定位; 经超薄切片, 透射电镜观察下摄片.
1.2.5 TJ结构的免疫胶体金标记: 取Millicell插入式培养皿培养的单层细胞, 用新鲜的30 g/L多聚甲醛+5 g/L戊二醛(GA)固定25 min, PBS冲洗后连膜一起切下; LR white低温包埋, 切片; BSA封闭; 一抗孵育1:20, 0.01 mol/L PBS 冲洗, 二抗孵育1:20, 0.01 mol/L PBS冲洗; 10 g/L GA固定, ddH2O冲洗; 30 g/L醋酸双氧铀, ddH2O冲洗; 半薄切片定位; 超薄切片, 透射电镜观察下摄片.
1.2.6 细胞骨架的表达: 将细胞培养在六孔板内的盖玻片上, 培养至融合, 细胞间TJ结构形成. 用40 g/L多聚甲醛固定, 室温下20-30 min, PBS漂洗5 min×3次; 2 mL/L Triton-X100漂洗10 min; 50 g/L BSA封闭20 min; FITC标记phalloidin(1:100)染色细胞骨架, 湿盒37℃孵育40 min; 80℃摇床, PBS漂洗15 min×3次; DAPI 30 μg/L室温下孵育, 甘油封片后LSCM激光共聚焦显微镜下观察摄片.
1.2.7 TJ结构相关蛋白的表达(免疫荧光): 将细胞接种于内含灭菌盖玻片的六孔培养板内, 待细胞长至单层, 按照实验分组进行处理. 标本用PBS漂洗2次, 40 g/L多聚甲醛室温下固定25 min后, 用PBS液漂洗3次. 采用两步法免疫组化染色, 单抗1:50-100稀释, 4℃过夜, FITC标记二抗1:25-50, 37℃孵育30 min, PBS液漂洗吸干后, LSCM镜下观察摄片, FITC(568 nm)激发后呈绿光.
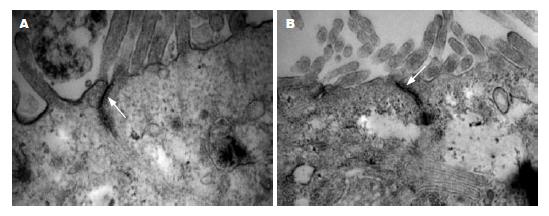
Caco-2细胞在Millicell插入式培养皿(PCF膜, 0.4 μm)培养7-10 d后, 固定包埋, 超薄切片透射电镜下观察(图1): Caco-2细胞顶部具有小肠绒毛样结构, TJ位于相邻细胞之间的顶端、两侧胞膜上, 呈浓集样表现, 中间有一缝隙, 测量直径在25-38 nm.
胶体金免疫标记, 超薄切片电镜观察: 细胞之间连接紧密, 形成肠绒毛样结构; 胶体金颗粒直径5 nm, 在相邻细胞之间的顶部有聚集, 分别位于两侧胞膜上, 中间有明显的孔隙, 即为TJ结构所在位置. EIEC感染后, 胶体金颗粒未见明显浓集, TJ结构标记不清(图2).
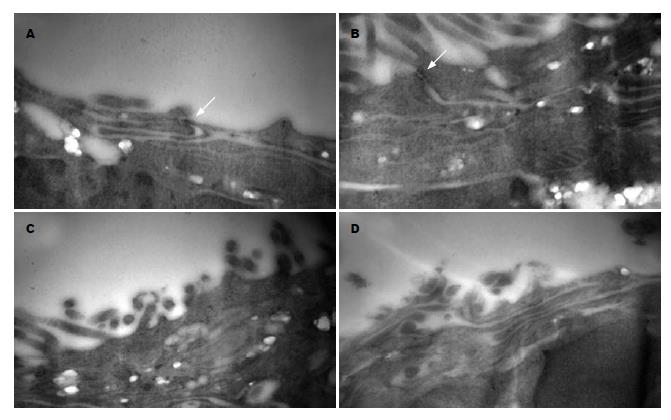
细胞骨架蛋白(F-actin)用FITC-phalloidin染色后LSCM下观察(图3): F-actin发绿光, 荧光分布于细胞膜及细胞骨架. 正常组: 细胞膜及细胞内荧光均较强, 可见明显的细胞内骨架分布, 呈条索状. 感染组: 细胞内荧光明显减少, 细胞骨架特征性条索状分布消失. 与正常组相比, 乳酸菌组和庆大组内细胞骨架荧光亦明显减少, 且细胞内荧光与胞膜荧光不连续.
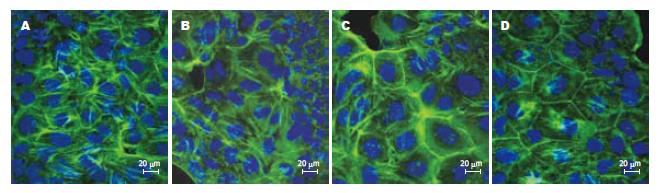
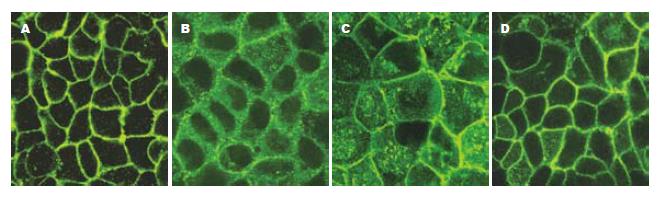
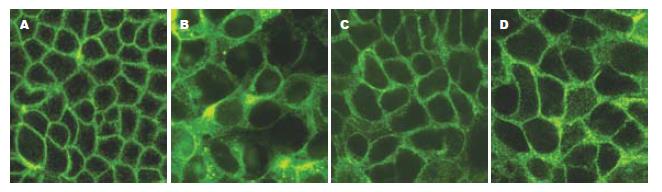
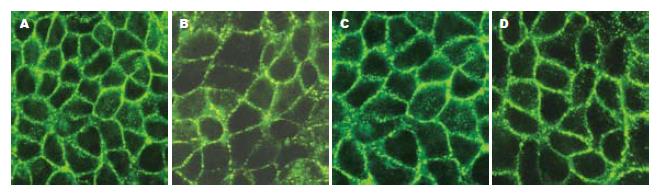
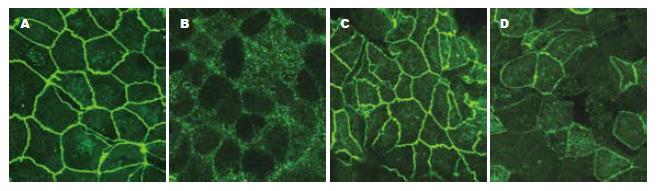
与免疫组化相比, TJ蛋白的免疫荧光表达更具有特异性, 背景较低. 激光共聚焦显微镜下见FITC激发后发绿光. TJ蛋白沿胞膜分布, 勾勒出细胞轮廓. 正常组细胞的Claudin-1, Occludin, JAM-1, ZO-1蛋白表达可见荧光沿胞膜分布, 边界清楚, 呈网状结构. EIEC感染Caco-2细胞后, 细胞间的荧光分布较正常组分散, 强度减弱. 细胞间隙增大, 因加入细菌的缘故, 细胞内可见较多小荧光颗粒. 乳酸菌处理组与正常组相比, TJ蛋白的荧光强度稍减弱, 但仍沿胞膜分布, 条带较清晰. 庆大霉素组与感染组相比, 细胞膜间荧光明显较强, 但与乳酸菌组亦有差别, 可见明显的细菌感染痕迹(图4-7).
肠道上皮细胞和相邻之间的紧密连接构成肠道的选择性屏障, 调节水和小分子物质的跨膜转运. 正常情况下, 肠道内各类细菌维持着肠道微生态的平衡. 一旦有外来致病菌侵入或人体免疫机能下降导致肠道条件致病菌激活, 则肠道上皮TJ结构遭受侵害, 肠黏膜通透性增高, 细菌或毒素异位而发生肠源性感染.
研究发现, EIEC黏附于肠道上皮细胞后, 可分泌效应分子引起肠道功能异常(电解质分泌紊乱、TJ屏障破坏、细菌异位感染等)或诱导细胞凋亡[5-6]. EIEC感染首先损害细胞骨架, 细胞骨架F-actin损伤破坏TJ结构可能的原因有: 细胞骨架F-actin在细胞内主要起到支撑作用, EIEC感染后细胞内F-actin表达减少, 可导致细胞内骨架支撑力不足, 细胞塌陷, 引起细胞间间隙增大, TJ结构遭到破坏; EIEC感染后细胞内F-actin表达减少, F-actin蛋白在细胞内将信息传递给与其相连的TJ结构蛋白, 导致TJ结构和蛋白表达功能障碍; EIEC感染后, 首先作用于紧密连接结构, 引起TJ相关蛋白破坏, 导致与其相连的F-actin的功能受损, 表达减少.
国外学者用致病性大肠杆菌(EPEC)感染T84细胞的实验发现[7], EPEC可作用于TJ, 导致ZO-1、Occludin和Claudin-1蛋白表达减少. Schneeberger et al[8]研究发现, TJ结构蛋白Claudin-1、Occludin、ZO-1、JAM-1均与细胞骨架F-actin相连, 细胞骨架F-actin的表达与TJ结构功能之间关系密切. 近年还有研究发现, 乳酸菌等益生菌可拮抗大肠杆菌引起的肠道通透性改变[4]. Resta-Lenert et al[9]将乳酸菌和双歧杆菌与大肠杆菌共培养, 结果发现, 大肠杆菌所致的肠道上皮通透性增加可明显减缓, TJ结构ZO-1蛋白的表达较感染组增多, 提示益生菌对肠道致病菌的感染具有保护作用.
本实验研究发现, Caco-2细胞在插入式培养皿上培养7-10 d后, 细胞相互融合形成TJ结构, 电镜下胶体金颗粒呈聚集样表现. 而EIEC感染后, 免疫胶体金未见明显浓集, 无法进行TJ结构的定位, 表明TJ相关蛋白的表达或其结构发生变化. 进一步研究发现, 在激光共聚焦显微镜下, 正常组TJ相关蛋白荧光表达呈网格状, 线条清晰, TJ蛋白分布位于胞膜上, 表明细胞间相互连接紧密, 单层细胞屏障功能完好. 而感染组荧光表达明显较分散, 表明TJ蛋白之间距离增大, 细胞旁间隙增大, 虽然仍可见胞膜及细胞轮廓, 但屏障功能可能已经受损. 同时, 细胞内F-actin荧光明显减少, 细胞骨架特征性条索状分布消失. 提示EIEC感染后, 紧密连接相关蛋白(Claudin-1, Occludin, ZO-1, JAM-1)的表达明显减少[10], 使得相邻细胞间原本正常的膜结构发生紊乱, 而这一异常可能是通过F-actin表达减少, 细胞骨架破坏造成的. 经乳酸菌处理后, 细胞间TJ蛋白表达增多且分布集中, 与正常组接近, 表明上皮细胞屏障功能得到保护, 庆大组作为乳酸菌组的对照, 两者的荧光表达近似. 同时, 细胞内F-actin表达明显增多. 提示乳酸菌可以修复EIEC引起细胞间紧密连接相关蛋白破坏, 这一作用可能与减少细胞骨架F-actin损伤有关[11-12].
结合已有的研究结果, 我们认为乳酸菌对EIEC的拮抗作用可能与减少EIEC对Caco-2细胞的黏附有关, 即乳酸菌黏附于肠道上皮细胞后可阻止EIEC的黏附, 从而减轻肠上皮的感染, 缓解TJ的损伤和降低肠道通透性. 但是目前, 有关的实验研究仅局限于表象, 具体的黏附机制及涉及的蛋白分子仍未完全了解, 详细深入的机制仍有待进一步阐明[13-14].
紧密连接是构成上皮屏障功能的最重要的结构, 由Claudin蛋白、Occludin蛋白、JAM、ZOs等结构蛋白及各类连接蛋白分子共同组成. 研究其相关结构和蛋白的变化对于了解肠道感染的发生、发展和防治具有十分重要的意义.
王炳元, 教授, 中国医科大学附属第一医院消化内科.
本研究采用免疫金标记及TEM电镜观察上皮细胞间TJ的位置和超微结构; 采用细胞免疫荧光观察TJ相关蛋白和细胞骨架F-actin在不同实验分组中的分布和结构变化, 为阐明肠道屏障功能的调控机制提供了线索.
目前国内的相关研究仅限于肠道通透性, 并未涉及TJ相关蛋白; 而国外的相关研究主要针对感染后TJ蛋白的变化, 或未涉及乳酸菌的保护作用, 因此本实验比较全面地作了分析和研究.
本实验首先采用免疫胶体金对EIEC感染TJ结构进行超微定位观察, 具有较强说服力; 同时采用免疫荧光电镜进行蛋白分析, 较为客观可信, 实验相关结果与国外文献有一致性, 但更为具体、详实.
目前相关的实验已进行至动物实验, 本课题为其提供了可靠的理论和实验数据支持, 结合临床的实验研究, 以期能全面地阐释肠道屏障功能的调控机制, 为临床病例的治疗提供一定帮助.
本文立题切合实际, 设计合理, 结果有重要的指导意义.
| 1. | Anderson JM. Molecular structure of tight junctions and their role in epithelial transport. News Physiol Sci. 2001;16:126-130. [PubMed] |
| 2. | Chiba H, Osanai M, Murata M, Kojima T, Sawada N. Transmembrane proteins of tight junctions. Biochim Biophys Acta. 2008;1778:588-600. [PubMed] |
| 3. | Heiskala M, Peterson PA, Yang Y. The roles of claudin superfamily proteins in paracellular transport. Traffic. 2001;2:93-98. [PubMed] [DOI] |
| 4. | Hashizume A, Ueno T, Furuse M, Tsukita S, Nakanishi Y, Hieda Y. Expression patterns of claudin family of tight junction membrane proteins in developing mouse submandibular gland. Dev Dyn. 2004;231:425-431. [PubMed] [DOI] |
| 5. | Torres AG, Zhou X, Kaper JB. Adherence of diarrheagenic Escherichia coli strains to epithelial cells. Infect Immun. 2005;73:18-29. [PubMed] [DOI] |
| 6. | Badea L, Doughty S, Nicholls L, Sloan J, Robins-Browne RM, Hartland EL. Contribution of Efa1/LifA to the adherence of enteropathogenic Escherichia coli to epithelial cells. Microb Pathog. 2003;34:205-215. [PubMed] [DOI] |
| 7. | Shifflett DE, Clayburgh DR, Koutsouris A, Turner JR, Hecht GA. Enteropathogenic E. coli disrupts tight junction barrier function and structure in vivo. Lab Invest. 2005;85:1308-1324. [PubMed] [DOI] |
| 8. | Schneeberger EE, Lynch RD. The tight junction: a multifunctional complex. Am J Physiol Cell Physiol. 2004;286:C1213-C1228. [PubMed] [DOI] |
| 9. | Resta-Lenert S, Barrett KE. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC). Gut. 2003;52:988-997. [PubMed] [DOI] |
| 10. | Oshitani N, Watanabe K, Nakamura S, Fujiwara Y, Higuchi K, Arakawa T. Dislocation of tight junction proteins without F-actin disruption in inactive Crohn's disease. Int J Mol Med. 2005;15:407-410. [PubMed] |
| 11. | Puthenedam M, Williams PH, Lakshmi BS, Balakrishnan A. Modulation of tight junction barrier function by outer membrane proteins of enteropathogenic Escherichia coli: role of F-actin and junctional adhesion molecule-1. Cell Biol Int. 2007;31:836-844. [PubMed] [DOI] |
| 12. | Ju Y, Wang T, Li Y, Xin W, Wang S, Li J. Coxsackievirus B3 affects endothelial tight junctions: possible relationship to ZO-1 and F-actin, as well as p38 MAPK activity. Cell Biol Int. 2007;31:1207-1213. [PubMed] [DOI] |
| 13. | Turner JR. Molecular basis of epithelial barrier regulation: from basic mechanisms to clinical application. Am J Pathol. 2006;169:1901-199. [PubMed] [DOI] |
| 14. | Johnson-Henry KC, Donato KA, Shen-Tu G, Gordanpour M, Sherman PM. Lactobacillus rhamnosus strain GG prevents enterohemorrhagic Escherichia coli O157:H7-induced changes in epithelial barrier function. Infect Immun. 2008;76:1340-1348. [PubMed] [DOI] |
编辑: 李军亮 电编:吴鹏朕