修回日期: 2008-04-23
接受日期: 2008-05-05
在线出版日期: 2008-07-18
目的: 研究人参皂苷Rg3对人肝癌细胞SMMC-7721中Pim-3及磷酸化Bad蛋白pBad(Ser112), pBad(Ser136)表达的影响.
方法: 用浓度为0、5、10、20、40和80 μmol/L的人参皂苷Rg3处理SMMC-7721细胞24 h后. 采用四甲基偶氮唑盐(MTT)方法检测人参皂苷Rg3对SMMC-7721细胞增殖的抑制作用, 倒置显微镜和流式细胞术观察人参皂苷Rg3对SMMC-7721细胞凋亡的诱导作用, Western blot方法检测不同浓度人参皂苷Rg3处理后SMMC-7721细胞中Pim-3, pBad(Ser112)和pBad(Ser136)的表达情况.
结果: 5、10、20、40和80 μmol/L的人参皂苷Rg3对SMMC-7721细胞增殖的抑制率分别为4.69%、15.53%、22.17%、50.97%、61.65%. 5-80 μmol/L的人参皂苷Rg3处理细胞呈现明显的凋亡形态学改变, 80 μmol/L人参皂苷Rg3处理SMMC-7721细胞24 h后,处理组比正常对照组凋亡明显增加, 差异有统计意义(16.5%±4.3% vs 0.4%±1.3%, P<0.01). 人参皂苷Rg3对细胞中Bad总蛋白的表达没有明显影响. Pim-3的表达随人参皂苷Rg3浓度的增加而逐渐减弱, 而pBad(Ser112)的表达随人参皂苷Rg3浓度的增加而逐渐增强; pBad(Ser136)不表达.
结论: 人参皂苷Rg3的抗癌活性与其促进磷酸化Bad蛋白表达有关.
引文著录: 简捷, 刘利珍, 李小燕, 胡志方, 王稻, 黄缘. 人参皂苷Rg3对人肝癌细胞Pim-3及Bad凋亡蛋白表达的影响. 世界华人消化杂志 2008; 16(20): 2229-2233
Revised: April 23, 2008
Accepted: May 5, 2008
Published online: July 18, 2008
AIM: To investigate the effects of ginsenoside Rg3 on the expression of Pim-3 and Bad phosphorylated proteins including pBad (Ser112) and pBad (Ser136) in human hepatocarcinoma cell line SMMC-7721.
METHODS: SMMC-7721 cells were exposed to 0, 5, 10, 20, 40 and 80 μmol/L ginsenoside Rg3 for 24 h. The effect of ginsenoside Rg3 on cell proliferation was measured using methyl thiazolyl tetrazolium (MTT) assay, and the apoptosis of SMMC-7721 cells was evaluated by inverted microscopy and flow cytometry. The expression of Pim-3 and pBad (Ser112) and pBad (ser136) were measured by Western blot.
RESULTS: The inhibitory rates were 4.69%, 15.53%, 22.17%, 50.97% and 61.65% respectively, after SMMC-7721 cells were exposed to 5, 10, 20, 40 and 80 μmol/L ginsenoside Rg3 for 24 h. Marked morphological changes of apoptosis were observed following exposure to 5-80 μmol/L ginsenoside Rg3. Flow cytometry showed the apoptosis rate was 0.39% in the normal control cells and 16.49% in the cells exposed to 80 μmol/L ginsenoside Rg3 for 24 h, indicating a marked elevation in apoptosis rate (P < 0.01). Ginsenoside Rg3 had no marked influences on the total Bad protein expression. Pim-3 expression was decreased with elevated ginsenoside Rg3 concentration, and the pBad (Ser112) was increased with elevated ginsenoside Rg3. But the pBad (Ser136) was not expressed.
CONCLUSION: The anti-cancer action of ginsenoside Rg3 may be associated with the decreased expression of Pim-3 and the increased expression of pBad (Ser112).
- Citation: Jian J, Liu LZ, Li XY, Hu ZF, Wang D, Huang Y. Effects of ginsenoside Rg3 on the expression of Pim-3 and Bad in human hepatocarcinoma cell lines. Shijie Huaren Xiaohua Zazhi 2008; 16(20): 2229-2233
- URL: https://www.wjgnet.com/1009-3079/full/v16/i20/2229.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i20.2229
胃人参皂苷Rg3是从中药人参中提取的单一成分, 具有抑制肿瘤细胞生长, 诱导肿瘤细胞凋亡, 并能选择性抑制肿瘤细胞转移和侵润及抑制肿瘤新生血管的形成, 而且还能明显提高化疗疗效, 起到化疗增敏的作用, 抑制肿瘤细胞生长[1]. Pim激酶家族是一组钙/钙调蛋白调节激酶(calcium/calmodulin-regulatede kinase, CAMP)家族, 该家族各成员(Pim-1, Pim-2, Pim-3)在激酶结构域高度同源, 其生物学功能也存在显著的重叠. 与其他丝/苏氨酸蛋白激酶如pI3k-Akt, mtor等一样, Pim家族激酶能使在细胞生长通路中起关键作用的蛋白质分子内的丝/苏氨酸残基磷酸化, 并通过不同于pI3k-Akt-mtor的另一条通路[2], 促进细胞的生存和增殖. 多种细胞生长因子、激素和细胞生长通路如JAK/STAT、pI3k和Akt等可在不同水平上介导Pim的表达[3]. 最近研究发现Pim-3在肝癌[4], 胰腺癌[5], 结肠癌[6]和胃癌[7]中异常表达增加. Pim激酶可活化Bad凋亡蛋白, 使其112位丝氨酸磷酸化, 从而失去活性, 细胞凋亡减少, 增殖增多[8]. 因此, Pim-3可能成为抗肿瘤治疗的一个新靶点. 我们采用体外细胞培养技术, 拟研究人参皂苷Rg3对人肝癌细胞SMMC-7721中Pim-3及磷酸化蛋白pBad(Ser112)和pBad(Ser136)表达的影响, 探讨人参皂苷Rg3抑制肝癌细胞增殖与其影响Pim-3表达和磷酸化Bad蛋白表达的关系.
人参皂苷Rg3购自吉林亚泰制药股份有限公司, MTT和胰酶购自美国Sigma公司, RPMI 1640培养基购自美国Gibco公司, 胎牛血清购自杭州四季青公司. 羊抗人Pim-3, Bad, pBad(Ser112)和pBad(Ser136)抗体购自美国Santa Cluz公司. 碱性磷酸酶标记兔抗羊二抗和BCIP/NBT显色系统购自美国Promega公司. SMMC-7721由江西省医学分子中心提供. 细胞常规培养于含100 mL/L胎牛血清的RPMI 1640培养液中. 人参皂苷Rg3用二甲基亚砜(DMSO)溶解, 配制成80 mmol/L的储备液, 用培养液稀释至所需浓度. DMSO在各组培养液中的终浓度均为1 mL/L.
1.2.1 人参皂苷Rg3对SMMC-7721细胞增殖的抑制作用检测: 取对数生长期的SMMC-7721细胞, 常规胰酶消化接种于96孔板, 每孔4×103个细胞, 培养24 h后加入人参皂苷Rg3使其终浓度为0, 5, 10, 20, 40和80 mmol/L, 每个浓度设6个平行孔. 培养24 h后加入5 g/L MTT 20 mL. 再培养4 h后倒尽板中的培养液, 各孔加100 mL DMSO, 轻轻振荡后用酶标仪(波长490 nm)测定各孔的吸光值, 以每组6个孔的平均值作为各组的平均值. 实验重复3次. 根据下列公式计算人参皂苷Rg3对SMMC-7721细胞的抑制率: 抑制率 = (1-实验值/对照值)×100%.
1.2.2 倒置显微镜观察人参皂苷Rg3对SMMC-7721细胞凋亡的作用: 常规培养SMMC-7721细胞, 按1×105个/孔接种于24孔细胞培养板. 用含不同溶度人参皂苷Rg3处理SMMC-7721细胞24 h后置倒置显微镜下观察其形态变化. 收集经人参皂苷Rg3处理过的SMMC-7721细胞, 制备细胞悬液, 于流式细胞仪检测细胞凋亡率.
1.2.3 检测人参皂苷Rg3对SMMC-7721细胞中Pim-3, Bad, pBad(Ser112)和pBad(ser136)表达的影响: 常规收集不同浓度人参皂苷Rg3处理24 h的细胞, 提取细胞总蛋白; 用Bradford法测定含量后, 取50 g总蛋白经100 g/L聚丙烯酰胺凝胶电泳分离并转移至硝酸纤维素膜上. 用含10 g/L BSA的TBST室温封闭1 h; 分别加1:600稀释的羊抗人Pim-3, Bad, pBad(Ser112)和pBad(Ser136)抗体, 室温孵育2 h, 用TBST漂洗10 min, 3次, 加1:7500稀释的碱性磷酸酶标记的二抗, 室温孵育1 h, 用TBST漂洗10 min, 3次, TBS漂洗2次, NBT/BCIP显色, 去离子水漂洗, 上海天能凝胶成像图像分析系统照相记录结果.
统计学处理 采用SPSS12.0统计软件进行单因素方差分析, 组间比较用LSD法.
在5-80 mmol/L浓度时, 人参皂苷Rg3对SMMC-7721细胞的增殖有明显抑制作用, 并且其抑制作用随着人参皂苷Rg3浓度的提高而增强(表1).
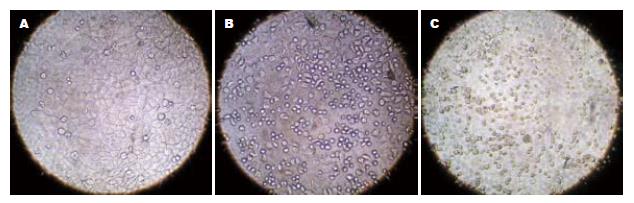
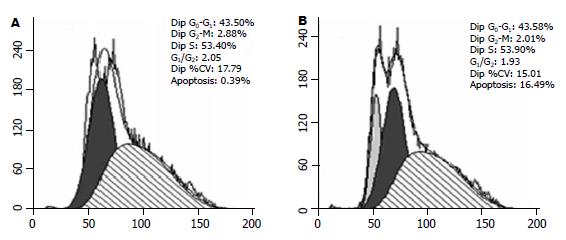
倒置显微镜下观察, 正常细胞呈现弥漫均匀, 细胞边缘整齐, 凋亡细胞变圆、体积缩小, 核碎裂呈大小不等的圆形小体. 本实验对照组偶见凋亡细胞, 而各人参皂苷Rg3处理组则可见较多的凋亡细胞, 并且随着人参皂苷Rg3浓度的提高, 凋亡细胞数明显增多(图1). 流式细胞术结果: 正常对照组凋亡细胞占(0.39±1.3)%; 80 mmol/L人参皂苷Rg3处理SMMC-7721细胞24 h后, 凋亡细胞占(16.49±4.3)%, 处理组比正常对照组凋亡明显增加, 差异有统计意义(P<0.01, 图2).
不同浓度人参皂苷Rg3处理SMMC-7721细胞24 h后, Pim-3的表达随人参皂苷Rg3浓度的增加而逐渐减弱; pBad(Ser112)的表达随人参皂苷Rg3浓度的增加而逐渐增强;人参皂苷Rg3对细胞中Bad总蛋白的表达没有明显影响, Bad总蛋白的表达不变; pBad(Ser136)不表达(图3).
人参皂苷Rg3作为一种抗肿瘤中药成分, 其抗癌活性引起广泛关注. 体内体外实验及流行病学研究结果显示, 人参皂苷Rg3对多种肿瘤均有抑制作用. 人参皂甙Rg3可选择性抑制癌细胞的浸润[9]. 通过体外抗浸润试验证明表明: 人参皂甙Rg3能明显抑制小鼠腹水肝癌细胞(rat ascites hepatoma cells MM1)、B16FE7黑色素瘤、人小细胞肺癌(OC10)和人胰腺癌细胞(PSN-1)的单层浸润[10]. 人参皂苷Rg3对高转移性的小鼠黑色素瘤细胞(B16FE7)肺转移及Balb/c小鼠结肠癌细胞(26-M3.1)肺转移具有抑制作用[11]. 本研究采用MTT方法也证实人参皂苷Rg3对SMMC-7721细胞体外增殖有抑制作用, 并且20-80 mmol/L的人参皂苷Rg3处理能诱导SMMC-7721细胞形成典型的凋亡形态学改变. 上述研究结果说明, 人参皂苷Rg3具有抑制肿瘤细胞增殖的作用.
Pim-3是一种丝/苏氨酸蛋白激酶Pim家族中的成员. Pim激酶主要通过以下途径来发挥其生物学作用: (1)抑制Bcl-2家族的前凋亡基因Bad,阻止Bad-Bcl-xl的相互作用, 抑制凋亡[12]; (2)使酪氨酸磷酸酶PTP-U2S磷酸化, 抑制其磷酸酶的活性, 从而阻止细胞凋亡的发生[13]; (3)通过协同或调控Bcl-2家族的抗凋亡蛋白的功能, 抑制细胞凋亡的线粒体通路[14]. 研究还发现Pim激酶具有加速细胞周期进程的效应[15]: (1)使p21磷酸化, 促使休眠期细胞进入细胞周期; (2)激活Cdc25A, 促进细胞的G1期进程; (3)抑制C-TAK1的活性, 促进G2/M转换; (4)激活STAT3信号途径, 促进细胞G1/S周期的进程. 本研究中我们发现, 不同浓度人参皂苷Rg3处理SMMC-7721细胞24 h后, 不同浓度人参皂苷Rg3处理SMMC-7721细胞24 h后, Pim-3的表达随人参皂苷Rg3浓度的增加而逐渐减弱, 而pBad(Ser112)的表达随人参皂苷Rg3浓度的增加而逐渐强; pBad(Ser136)不表达. 因此, 人参皂苷Rg3可通过促进Bad活性形式-磷酸化Bad的形成而诱导肿瘤细胞的凋亡、抑制肿瘤细胞的增殖.
总之, Pim-3可成为肿瘤治疗的一个新靶点, 本研究结果表明, 抑制Pim-3的表达可能是人参皂苷Rg3诱导人肝癌细胞SMMC-7721细胞凋亡, 抑制其增殖的原因之一.
研究表明人参皂苷Rg3对多种肿瘤均有抑制作用. Pim-3作为一种丝/苏氨酸蛋白激酶Pim家族中的成员, 具有磷酸化凋亡蛋白Bad,抑制细胞凋亡, 促进细胞增值. 在人类许多肿瘤中均发现Pim-3. 因此, Pim-3及Bad可成为抗肿瘤治疗的一个新靶点. 探讨Pim-3抑制肝癌细胞增值与其影响磷酸化Bad蛋白表达的关系有助于揭示人参皂苷Rg3的抗癌机制, 为将来人参皂苷Rg3应用于预防和治疗肝癌提供理论依据.
王学美, 研究员, 北京大学第一医院中西医结合研究室
自从发现人参皂苷Rg3能选择性抑制肿瘤细胞转移和侵润及抑制肿瘤新生血管的形成, 其抗癌活性引起广泛关注. 体内体外实验及流行病学研究结果显示, 人参皂苷Rg3对多种肿瘤均有抑制作用. 研究人参皂苷Rg3对肿瘤细胞中信号传导途径的调节作用已经成为研究其抗癌活性机制的一个重要环节.
研究已发现人参皂甙Rg3能明显抑制小鼠腹水肝癌细胞、黑色素瘤、人小细胞肺癌和人胰腺癌细胞的单层浸润.
本研究发现人参皂甙Rg3抑制Pim-3的表达, 促进pBad(Ser112)的表达可能是人参皂苷Rg3诱导人肝癌细胞SMMC-7721细胞凋亡, 抑制其增殖的原因之一.
探讨人参皂甙Rg3抑制肝癌细胞增值与其影响Pim-3以及pBad(Ser112)的表达的关系有助于揭示人参皂甙Rg3的抗癌机制, 为将来人参皂甙Rg3应用于预防和治疗肝癌提供理论依据.
Pim激酶家族: 是一组丝/苏氨酸激酶Pim家族, 他拥有3个成员分别为Pim-1, Pim-2, Pim-3. 该家族各成员在激酶结构域高度同源, 其生物学功能也存在显著的重叠. Pim激酶家族能使在细胞生长通路中起关键作用的蛋白质分子内的丝/苏氨酸残基磷酸化, 并通过不同于pI3k-Akt-mtor的另一条通路, 促进细胞的生存和增殖.
本文思路清晰, 行文流畅, 论据充分, 参考文献全面, 具有一定的学术价值.
| 1. | Iishi H, Tatsuta M, Baba M, Uehara H, Nakaizumi A, Shinkai K, Akedo H, Funai H, Ishiguro S, Kitagawa I. Inhibition by ginsenoside Rg3 of bombesin-enhanced peritoneal metastasis of intestinal adenocarcinomas induced by azoxymethane in Wistar rats. Clin Exp Metastasis. 1997;15:603-611. [PubMed] [DOI] |
| 2. | Fox CJ, Hammerman PS, Thompson CB. The Pim kinases control rapamycin-resistant T cell survival and activation. J Exp Med. 2005;201:259-266. [PubMed] [DOI] |
| 3. | Jacobs MD, Black J, Futer O, Swenson L, Hare B, Fleming M, Saxena K. Pim-1 ligand-bound structures reveal the mechanism of serine/threonine kinase inhibition by LY294002. J Biol Chem. 2005;280:13728-13734. [PubMed] [DOI] |
| 4. | Fujii C, Nakamoto Y, Lu P, Tsuneyama K, Popivanova BK, Kaneko S, Mukaida N. Aberrant expression of serine/threonine kinase Pim-3 in hepatocellular carcinoma development and its role in the proliferation of human hepatoma cell lines. Int J Cancer. 2005;114:209-218. [PubMed] [DOI] |
| 5. | Li YY, Popivanova BK, Nagai Y, Ishikura H, Fujii C, Mukaida N. Pim-3, a proto-oncogene with serine/threonine kinase activity, is aberrantly expressed in human pancreatic cancer and phosphorylates bad to block bad-mediated apoptosis in human pancreatic cancer cell lines. Cancer Res. 2006;66:6741-6747. [PubMed] [DOI] |
| 6. | Popivanova BK, Li YY, Zheng H, Omura K, Fujii C, Tsuneyama K, Mukaida N. Proto-oncogene, Pim-3 with serine/threonine kinase activity, is aberrantly expressed in human colon cancer cells and can prevent Bad-mediated apoptosis. Cancer Sci. 2007;98:321-328. [PubMed] [DOI] |
| 7. | Zheng HC, Tsuneyama K, Takahashi H, Miwa S, Sugiyama T, Popivanova BK, Fujii C, Nomoto K, Mukaida N, Takano Y. Aberrant Pim-3 expression is involved in gastric adenoma-adenocarcinoma sequence and cancer progression. J Cancer Res Clin Oncol. 2008;134:481-488. [PubMed] [DOI] |
| 8. | Yan B, Zemskova M, Holder S, Chin V, Kraft A, Koskinen PJ, Lilly M. The PIM-2 kinase phosphorylates BAD on serine 112 and reverses BAD-induced cell death. J Biol Chem. 2003;278:45358-45367. [PubMed] [DOI] |
| 9. | Xu TM, Xin Y, Cui MH, Jiang X, Gu LP. Inhibitory effect of ginsenoside Rg3 combined with cyclophosphamide on growth and angiogenesis of ovarian cancer. Chin Med J (Engl). 2007;120:584-588. [PubMed] |
| 10. | Shinkai K, Akedo H, Mukai M, Imamura F, Isoai A, Kobayashi M, Kitagawa I. Inhibition of in vitro tumor cell invasion by ginsenoside Rg3. Jpn J Cancer Res. 1996;87:357-362. [PubMed] |
| 11. | Mochizuki M, Yoo YC, Matsuzawa K, Sato K, Saiki I, Tono-oka S, Samukawa K, Azuma I. Inhibitory effect of tumor metastasis in mice by saponins, ginsenoside-Rb2, 20(R)- and 20(S)-ginsenoside-Rg3, of red ginseng. Biol Pharm Bull. 1995;18:1197-1202. [PubMed] |
| 12. | Aho TL, Sandholm J, Peltola KJ, Mankonen HP, Lilly M, Koskinen PJ. Pim-1 kinase promotes inactivation of the pro-apoptotic Bad protein by phosphorylating it on the Ser112 gatekeeper site. FEBS Lett. 2004;571:43-49. [PubMed] [DOI] |
| 13. | Wang Z, Bhattacharya N, Meyer MK, Seimiya H, Tsuruo T, Tonani JA, Magnuson NS. Pim-1 negatively regulates the activity of PTP-U2S phosphatase and influences terminal differentiation and apoptosis of monoblastoid leukemia cells. Arch Biochem Biophys. 2001;390:9-18. [PubMed] [DOI] |
| 14. | Lilly M, Sandholm J, Cooper JJ, Koskinen PJ, Kraft A. The PIM-1 serine kinase prolongs survival and inhibits apoptosis-related mitochondrial dysfunction in part through a bcl-2-dependent pathway. Oncogene. 1999;18:4022-4031. [PubMed] [DOI] |
| 15. | Bachmann M, Hennemann H, Xing PX, Hoffmann I, Moroy T. The oncogenic serine/threonine kinase Pim-1 phosphorylates and inhibits the activity of Cdc25C-associated kinase 1 (C-TAK1): a novel role for Pim-1 at the G2/M cell cycle checkpoint. J Biol Chem. 2004;279:48319-48328. [PubMed] [DOI] |
编辑: 李军亮 电编:郭海丽