修回日期: 2007-10-12
接受日期: 2007-10-28
在线出版日期: 2007-11-18
目的: 研究细胞骨架4.1蛋白家族成员(4.1 B、4.1R、4.1G和4.1N)在胃癌组织中的表达及意义.
方法: 应用Envision+免疫组织化学的方法检测104例胃癌(男77例、女27例, 中位年龄61.7岁, 每例均有详细的临床资料和手术记录. 所有病例术前均未进行放疗、化疗)中4.1蛋白家族成员的表达情况.
结果: 在胃癌组织中, 4.1B, 4.1R, 4.1G和4.1N的表达程度和其在癌旁对照组织中的表达程度均有明显差异(P<0.01), 4.1B, 4.1G和4.1N的表达程度随着胃癌组织的分化程度降低而减弱, 与癌组织分化程度显著相关(PB<0.05, PG<0.01, PN<0.01), 在有淋巴结转移的胃癌中, 4.1B, 4.1N的表达程度明显低于无淋巴结转移者(PB<0.05, PN<0.01). 由于仅浸润黏膜层的病例过少, 4.1蛋白家族成员的表达与浸润均无相关性(P>0.05).
结论: 4.1B, 4.1G和4.1N参与胃癌的分化调节, 4.1B和4.1N则在胃癌的淋巴结转移过程中发挥作用.
引文著录: 许晶晶, 陈鲤翔, 翟文杰, 冯文坡, 祁元明. 胃癌组织中细胞骨架4.1蛋白家族的表达意义. 世界华人消化杂志 2007; 15(32): 3408-3412
Revised: October 12, 2007
Accepted: October 28, 2007
Published online: November 18, 2007
AIM: To investigate the expression and signi-ficance of four members (4.1B, 4.1R, 4.1G and 4.1N) of membrane skeleton protein 4.1 family in human gastric carcinoma tissues.
METHODS: Expression of 4.1B, 4.1R, 4.1G and 4.1N was examined by immunohistochemistry (Envision+ assay) in archival paraffin-embedded gastric carcinoma tissues from 104 patients (77 males, 27 females, median age 61.7 years). Each case had detailed clinical data and surgical records. None of the patients were treated by radiotherapy or chemotherapy before surgery.
RESULTS: In gastric carcinoma, the expression of 4.1B, 4.1R, 4.1G and 4.1N was significantly different from that in normal gastric tissue (P < 0.01). The expression of 4.1B, 4.1G and 4.1N was significantly reduced when tumor differentiation became lower, which suggested these three members were significantly correlated with tumor differentiation status (PB < 0.05, PG < 0.01, PN < 0.01). In gastric carcinoma with lymph node metastasis, the expression of 4.1B and 4.1N was significantly lower than that in tumors without lymph node metastasis (PB < 0.05, PN < 0.01).
CONCLUSION: Abnormal expression of 4.1B, 4.1G and 4.1N is related to the degree of tumor malignancy. Abnormal expression of 4.1N and 4.1B is related to lymph node metastasis of gastric cancer.
- Citation: Xu JJ, Chen LX, Zhai WJ, Feng WP, Qi YM. Expression and significance of membrane skeleton protein 4.1s in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2007; 15(32): 3408-3412
- URL: https://www.wjgnet.com/1009-3079/full/v15/i32/3408.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i32.3408
蛋白4.1(指红细胞膜蛋白经SDS-PAGE后第4.1条显色带)是红细胞中以血影蛋白(spectrin)为基础的细胞膜骨架的一个基本成分[1], 在维持红细胞正常的形态和生物物理特性方面有重要作用. 蛋白4.1基因的缺失会导致红细胞畸形和溶血[2]. 蛋白4.1家族包括4.1R、4.1N、4.1G和4.1B[3]. 他们都具有一些相同的结构域: SABD结构域(spectrin-actin-binding domain), FERM结构域(在four.one/ezrin/radixin/moesin及merlin/NF2蛋白中都有该结构域)或称膜结合结构域(membrane binding domain, MBD)和CTD结构域(C-terminal domain)[4].
研究发现, 在脑膜瘤[5]、室管膜瘤[6]、非小细胞肺癌[7]和乳腺癌[8]等多种肿瘤中, 4.1蛋白的表达缺失, 并且越来越多的临床和实验证据证实编码4.1蛋白的基因在多种肿瘤中表现出抑癌基因的作用[9], 表明4.1蛋白与肿瘤的发生和发展有着密切的关系. 目前国内外尚没有关于4.1蛋白家族成员在胃癌标本中的表达情况, 及其与胃癌发生、发展之间相关性的报道. 我们用Envision+免疫组织化学[10]的方法来检测4.1蛋白家族成员在胃癌中的表达情况, 并探讨4.1蛋白家族成员的表达与胃癌发生、发展的关系, 以期为胃癌诊断、治疗和判断预后提供依据.
2005/01-2006/06郑州大学附属医院胃癌手术标本蜡块共104例, 男77例、女27例, 中位年龄61.7(35-88)岁. 将104例癌旁组织中符合对照原则的68例做为对照组. 每例均有详细的临床资料和手术记录. 所有病例术前均未进行放、化疗. 伴有淋巴结转移者51例. 参照1981年WHO推荐的分化分级标准: 高分化腺癌30例, 中分化腺癌28例, 低分化腺癌46例. 兔多抗4.1R、4.1N、4.1G、4.1B抗体由美国纽约血液中心安秀丽博士馈赠, Envision+免疫组化试剂盒为美国Dako公司产品.
所有蜡块做4 μm连续切片, 每个蜡块均切5-6张, 1张行HE染色, 作组织学诊断, 其余做免疫组化染色. 程序按Dako Envision+免疫组化试剂盒说明书进行. 4.1R、N、B染色前行热抗原修复, G行酶抗原修复. DAB显色, 苏木素轻度复染. PBS代替一抗做阴性对照, 癌旁组织做阳性对照. 免疫组化染色阳性结果为质膜或胞质, 胞核内出现棕褐色颗粒或染色. 结果判定按半定量评分标准进行, 具体如下: 在高倍镜下, 与周围间质相比, 无着色记为0分, 浅褐色记为1分, 褐色为2分, 深褐色为3分; 阳性细胞百分率<10%记为0分, 10%-50%记为1分, 50%-75%记为2分, 75%以上记为3分, 两者相加为综合染色强度评分. 0-1分为阴性, 记为"-", 2分为弱阳性, 记为"+", 3-4分为阳性, 记为"++", 5-6分为强阳性, 记为"+++". 每张切片均判读癌组织及癌旁组织的染色强度.
统计学处理 采用SAS 9.13分析软件包行统计学处理. 应用卡方检验分析4.1B, 4.1R, 4.1G和4.1N表达与临床病理的关系.
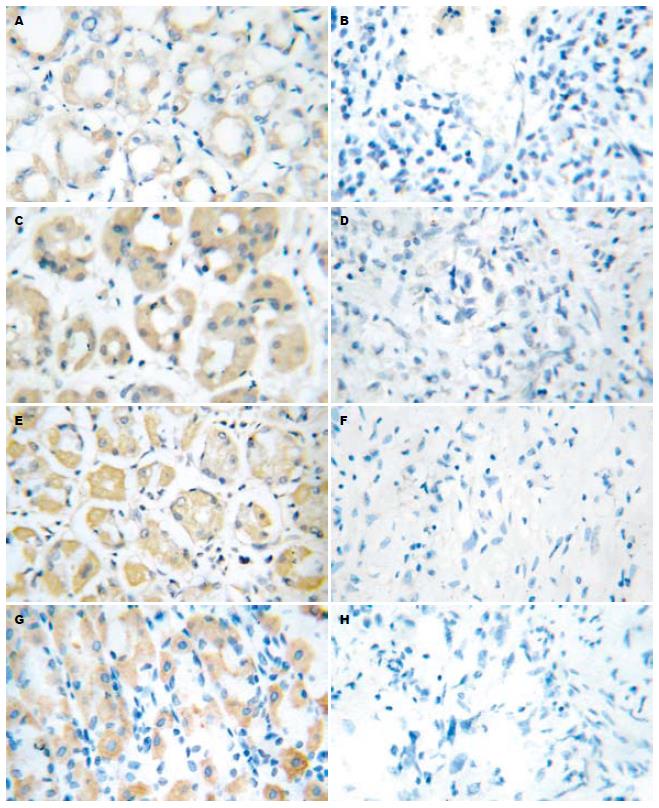
4.1B, 4.1R, 4.1G和4.1N在胃癌组织中的表达程度明显低于癌旁对照组(图1), 两者之间差异显著(P<0.01, 表1).
4.1B、4.1G和4.1N的表达程度随着癌组织分化的降低而减弱(PB<0.05, PG<0.01, PN<0.01), 4.1R的表达程度随着癌组织分化程度降低而减弱的趋势, 但是差异无统计学意义(PR>0.05, 表1).
4.1B和4.1N的表达程度在伴有淋巴结转移和未伴有淋巴结转移的病例中的差异有统计学意义(PB<0.05, PN<0.01). 4.1R和4.1N的表达程度在伴有淋巴结转移的病例和未伴有淋巴结转移的病例中的差异无统计学意义(P>0.05, 表1). 由于浸润深度仅限于黏膜层的病例过少, 4.1B、4.1R、4.1G和4.1N的表达程度在不同浸润深度的病例中差异无统计学意义(P>0.05).
胃癌是严重威胁人类健康的消化道恶性肿瘤, 发病率位居肿瘤类疾病的第2位[11]. 深入研究胃癌的发病机制以及早期诊断、预后评估的方法具有十分重要的临床和社会价值. 胃癌的发生涉及原癌基因的激活与抑癌基因的失活所造成的异常细胞增殖及分化调控[12], 而且胃癌的发生、发展过程与E-cadherin和CD44等黏附分子密切相关[13-14]. Charboneau et al[15]发现, 将4.1B/DAL-1蛋白基因导入缺失4.1B/DAL-1蛋白的乳腺癌细胞系后, 其生长受到抑制, 且细胞与细胞之间的粘连性增强, 表明4.1B/DAL-1蛋白基因可能起到抑癌基因的作用. 作为细胞膜蛋白与细胞骨架之间的连接子, 4.1B蛋白能够与E-cadherin和CD44等多个隶属于不同家族的黏附分子结合[16-17], 和细胞转移[18]存在相关性. 4.1蛋白家族的另一成员, 4.1R蛋白能够和NuMA(核有丝分裂器)相互作用, 参与细胞的有丝分裂[19], 同时还参与调节细胞的mRNA翻译, 是联系翻译装置和细胞骨架的桥梁分子[20]. 这些研究均证明4.1R参与对细胞增殖分裂的调节. 已有研究表明, 4.1R蛋白和脑膜瘤的发生发展密切相关[21], 推测4.1R蛋白在脑膜瘤中起到肿瘤抑制因子的作用.
4.1G蛋白是第1个被发现的可与亲免素家族成员FKBP13结合的有生理活性的蛋白质[22], 而亲免素家族[23]是一个高度同源的伴侣分子蛋白家族, FKBP13就参与内质网蛋白的分泌[24]提示4.1G可能起到分子伴侣的作用, 催化蛋白质在内质网进行折叠、聚集和分泌, 对蛋白质的功能起到调节作用. 而其是否能通过影响其他调节胃癌发生、发展过程的蛋白质的功能而参与胃癌的进展尚需要进一步研究. 4.1N与4.1R的结构较为类似. Ye et al[25]研究发现, 4.1N的CTD结构域可与NuMA(核有丝分裂器)[26]结合, 抑制4.1N的入核可阻止NGF介导的细胞分裂停滞, 而4.1N的过量表达, 则可逆转该过程. 因此推测, 4.1N可通过拮抗NuMA在有丝分裂中的作用来介导NGF的抗增殖作用, 而4.1N这种参与有丝分裂的功能在我们的研究中也有所体现. 迄今为止, 对4.1G和4.1N蛋白在肿瘤发病过程中所起作用的研究鲜有报道. 考虑到4.1蛋白家族成员间的分子结构[27]具有很高的同源性, 推测他们在功能上可能也具有相似性. 本研究对4.1蛋白家族不同成员在胃癌组织中表达情况及其与胃癌发病机制的相关性进行了深入的研究并证实了这种推断.
本研究的结果表明, 4.1蛋白家族的成员4.1B, 4.1R, 4.1G和4.1N的阳性表达程度在癌和癌旁对照组织中都存在明显的差异, 4.1蛋白家族成员的表达程度在胃癌组织中明显降低甚至消失, 提示4.1蛋白与胃癌的发生、发展密切相关. 4.1B、4.1G和4.1N蛋白的表达程度均随着肿瘤分化程度的降低而降低, 提示这3个蛋白可能参与胃黏膜上皮分化的调节过程. 伴有淋巴结转移的病例中, 4.1B和4.1N的阳性表达程度明显低于无淋巴结转移的病例, 提示4.1B和4.1N可能参与胃癌的淋巴结转移过程. 4.1蛋白作为重要的膜骨架成分[28], 可能在细胞黏附因子和细胞内信息传导中[29]处于"信号中转站"的关键性作用, 并因此在肿瘤的发生、发展的过程中起到重要作用. 本研究关于4.1蛋白与胃癌发病相关性研究的结果证实了这种推断. 值得注意的是, 4.1R蛋白的表达虽然在癌和癌旁组织中有明显差异, 但未发现其与癌组织的分化、转移和浸润有任何关系, 可认为4.1R的表达降低乃至缺失是胃癌发生的早期事件[30]. 研究表明, 4.1R可以和NuMA相互作用而参与细胞的有丝分裂, 而4.1R蛋白具体是通过何种途径参与胃癌的发生、发展过程, 仍需要进一步研究.
总之, 本研究表明, 4.1蛋白家族成员在胃癌的发生、发展的过程中起到重要作用, 可以作为衡量胃癌分化、预后的指标, 但还需要做进一步的工作以阐明其作用的机制. 而进一步阐明4.1蛋白在胃癌浸润、转移过程中的作用机制也将为胃癌发病机制的研究提供新的依据并且有可能为胃癌的治疗提供一个新的靶点.
蛋白4.1(指红细胞膜蛋白经SDS-PAGE 后第4.1条显色带)是红细胞中以血影蛋白(spectrin)为基础的细胞膜骨架的一个基本成分, 在维持红细胞正常的形态和生物物理特性方面有重要作用. 蛋白4.1基因的缺失会导致红细胞畸形和溶血. 蛋白4.1家族包括4.1R、4.1N、4.1G和4.1B. 他们都具有一些相同的结构域: SABD结构域(spectrin-actin-binding domain). FERM结构域(在four.one/ezrin/radixin/moesin及merlin/NF2蛋白中都有该结构域)或称膜结合结构域(membrane binding domain, MBD)和CTD结构域(C-terminal domain).
研究发现, 在脑膜瘤、室管膜瘤、非小细胞肺癌和乳腺癌等多种肿瘤中, 4.1蛋白的表达缺失, 并且越来越多的临床和实验证据证实编码4.1蛋白的基因在多种肿瘤中表现出抑癌基因的作用.
目前国内外尚没有关于4.1蛋白家族成员在胃癌标本中的表达情况, 及其与胃癌发生、发展之间相关性的报道.
本文用Envision+免疫组织化学的方法来检测4.1蛋白家族成员在胃癌中的表达情况, 并探讨4.1蛋白家族成员的表达与胃癌发生、发展的关系, 以期为胃癌诊断、治疗和判断预后提供依据.
本文具有较强的创新性, 研究内容比较具体完整, 设计合理, 结果详实, 对胃癌的研究具有一定的理论指导意义.
| 1. | Diakowski W, Grzybek M, Sikorski AF. Protein 4.1, a component of the erythrocyte membrane skeleton and its related homologue proteins forming the protein 4.1/FERM superfamily. Folia Histochem Cytobiol. 2006;44:231-248. [PubMed] |
| 2. | Conboy J, Marchesi S, Kim R, Agre P, Kan YW, Mohandas N. Molecular analysis of insertion/deletion mutations in protein 4.1 in elliptocytosis. II. Determination of molecular genetic origins of rearrangements. J Clin Invest. 1990;86:524-530. [PubMed] |
| 3. | Calinisan V, Gravem D, Chen RP, Brittin S, Mohandas N, Lecomte MC, Gascard P. New insights into potential functions for the protein 4.1 superfamily of proteins in kidney epithelium. Front Biosci. 2006;11:1646-1666. [PubMed] |
| 4. | Hoover KB, Bryant PJ. The genetics of the protein 4.1 family: organizers of the membrane and cytoskeleton. Curr Opin Cell Biol. 2000;12:229-234. [PubMed] |
| 5. | Robb VA, Li W, Gascard P, Perry A, Mohandas N, Gutmann DH. Identification of a third Protein 4.1 tumor suppressor, Protein 4.1R, in meningioma pathogenesis. Neurobiol Dis. 2003;13:191-202. [PubMed] |
| 6. | Rajaram V, Gutmann DH, Prasad SK, Mansur DB, Perry A. Alterations of protein 4.1 family members in ependymomas: a study of 84 cases. Mod Pathol. 2005;18:991-997. [PubMed] |
| 7. | Kikuchi S, Yamada D, Fukami T, Masuda M, Sakurai-Yageta M, Williams YN, Maruyama T, Asamura H, Matsuno Y, Onizuka M. Promoter methylation of DAL-1/4.1B predicts poor prognosis in non-small cell lung cancer. Clin Cancer Res. 2005;11:2954-2961. [PubMed] |
| 8. | Kittiniyom K, Mastronardi M, Roemer M, Wells WA, Greenberg ER, Titus-Ernstoff L, Newsham IF. Allele-specific loss of heterozygosity at the DAL-1/4.1B (EPB41L3) tumor-suppressor gene locus in the absence of mutation. Genes Chromosomes Cancer. 2004;40:190-203. [PubMed] |
| 9. | Wong SY, Haack H, Kissil JL, Barry M, Bronson RT, Shen SS, Whittaker CA, Crowley D, Hynes RO. Protein 4.1B suppresses prostate cancer progression and metastasis. Proc Natl Acad Sci U S A. 2007;104:12784-12789. [PubMed] |
| 10. | Roskams T. The role of immunohistochemistry in diagnosis. Clin Liver Dis. 2002;6:571-589. [PubMed] |
| 11. | Anderson C, Nijagal A, Kim J. Molecular markers for gastric adenocarcinoma: an update. Mol Diagn Ther. 2006;10:345-352. [PubMed] |
| 12. | Sarbia M, Becker KF, Hofler H. Pathology of upper gastrointestinal malignancies. Semin Oncol. 2004;31:465-475. [PubMed] |
| 13. | Chan AO, Lam SK, Chu KM, Lam CM, Kwok E, Leung SY, Yuen ST, Law SY, Hui WM, Lai KC. Soluble E-cadherin is a valid prognostic marker in gastric carcinoma. Gut. 2001;48:808-811. [PubMed] |
| 14. | Harn HJ, Ho LI, Shyu RY, Yuan JS, Lin FG, Young TH, Liu CA, Tang HS, Lee WH. Soluble CD44 isoforms in serum as potential markers of metastatic gastric carcinoma. J Clin Gastroenterol. 1996;22:107-110. [PubMed] |
| 15. | Charboneau AL, Singh V, Yu T, Newsham IF. Suppression of growth and increased cellular attachment after expression of DAL-1 in MCF-7 breast cancer cells. Int J Cancer. 2002;100:181-188. [PubMed] |
| 16. | Nunomura W, Takakuwa Y, Tokimitsu R, Krauss SW, Kawashima M, Mohandas N. Regulation of CD44-protein 4.1 interaction by Ca2+ and calmodulin. Implications for modulation of CD44-ankyrin interaction. J Biol Chem. 1997;272:30322-30338. [PubMed] |
| 17. | Hiscox S, Jiang WG. Ezrin regulates cell-cell and cell-matrix adhesion, a possible role with E-cadherin/beta-catenin. J Cell Sci. 1999;112 Pt 18:3081-3090. [PubMed] |
| 18. | Yageta M, Kuramochi M, Masuda M, Fukami T, Fukuhara H, Maruyama T, Shibuya M, Murakami Y. Direct association of TSLC1 and DAL-1, two distinct tumor suppressor proteins in lung cancer. Cancer Res. 2002;62:5129-5133. [PubMed] |
| 19. | Huang SC, Liu ES, Chan SH, Munagala ID, Cho HT, Jagadeeswaran R, Benz EJ Jr. Mitotic regulation of protein 4.1R involves phosphorylation by cdc2 kinase. Mol Biol Cell. 2005;16:117-127. [PubMed] |
| 20. | Mattagajasingh SN, Huang SC, Hartenstein JS, Snyder M, Marchesi VT, Benz EJ. A nonerythroid isoform of protein 4.1R interacts with the nuclear mitotic apparatus (NuMA) protein. J Cell Biol. 1999;145:29-43. [PubMed] |
| 21. | Perry A, Gutmann DH, Reifenberger G. Molecular pathogenesis of meningiomas. J Neurooncol. 2004;70:183-202. [PubMed] |
| 22. | Walensky LD, Gascard P, Fields ME, Blackshaw S, Conboy JG, Mohandas N, Snyder SH. The 13-kD FK506 binding protein, FKBP13, interacts with a novel homologue of the erythrocyte membrane cytoskeletal protein 4.1. J Cell Biol. 1998;141:143-153. [PubMed] |
| 23. | Chelu MG, Danila CI, Gilman CP, Hamilton SL. Regulation of ryanodine receptors by FK506 binding proteins. Trends Cardiovasc Med. 2004;14:227-234. [PubMed] |
| 24. | Neye H, Verspohl EJ. The FK506 binding protein 13 kDa (FKBP13) interacts with the C-chain of complement C1q. BMC Pharmacol. 2004;4:19. [PubMed] |
| 25. | Ye K, Compton DA, Lai MM, Walensky LD, Snyder SH. Protein 4.1N binding to nuclear mitotic apparatus protein in PC12 cells mediates the antiproliferative actions of nerve growth factor. J Neurosci. 1999;19:10747-10756. [PubMed] |
| 26. | Zeng C. NuMA: a nuclear protein involved in mitotic centrosome function. Microsc Res Tech. 2000;49:467-477. [PubMed] |
| 27. | Ramez M, Blot-Chabaud M, Cluzeaud F, Chanan S, Patterson M, Walensky LD, Marfatia S, Baines AJ, Chasis JA, Conboy JG. Distinct distribution of specific members of protein 4.1 gene family in the mouse nephron. Kidney Int. 2003;63:1321-1337. [PubMed] |
| 28. | Shi ZT, Afzal V, Coller B, Patel D, Chasis JA, Parra M, Lee G, Paszty C, Stevens M, Walensky L. Protein 4.1R-deficient mice are viable but have erythroid membrane skeleton abnormalities. J Clin Invest. 1999;103:331-340. [PubMed] |
| 29. | Ohno N, Terada N, Yamakawa H, Komada M, Ohara O, Trapp BD, Ohno S. Expression of protein 4.1G in Schwann cells of the peripheral nervous system. J Neurosci Res. 2006;84:568-577. [PubMed] |
| 30. | Gutmann DH, Donahoe J, Perry A, Lemke N, Gorse K, Kittiniyom K, Rempel SA, Gutierrez JA, Newsham IF. Loss of DAL-1, a protein 4.1-related tumor suppressor, is an important early event in the pathogenesis of meningiomas. Hum Mol Genet. 2000;9:1495-1500. [PubMed] |
编辑: 何燕 电编:郭海丽