修回日期: 2006-10-12
接受日期: 2006-10-14
在线出版日期: 2007-01-18
目的: 观察一氧化氮合酶抑制剂N-硝基精氨酸甲酯(L-NAME)对大肠癌细胞的抑制作用, 以及对移植瘤内血管生成的影响.
方法: 建立大肠癌裸鼠移植瘤模型再随机分为生理盐水对照组(n = 6, 0.2 mL)、L-NAME组(n = 6, 1.5 mg/kg)、5-FU组(n = 6, 5 mg/kg)、L-NAME+5-FU联合组(n = 6, L-NAME 1.5 mg/kg, 5-FU 5 mg/kg), 皆以灌胃方式给药, 3次/wk, 共2 wk. 测量各组肿瘤体积, 观察L-NAME的体内抗瘤作用. 采用免疫组化方法观察移植瘤的微血管密度(MVD), 用Western blot方法检测肿瘤组织VEGF蛋白的表达.
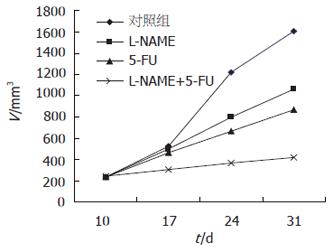
结果: L-NAME, 5-FU, L-NAME+5-FU组抑瘤率分别为34.1%、46.0%、74.1%, 与对照组比较, 有显著性差异(P<0.01), 联合治疗组与L-NAME, 5-FU组比较, 差异也有显著性(P<0.01); MVD值对照组为28.9±2.7, L-NAME组为16.2±3.1, 与对照组比较, 差异有显著性(P<0.05); L-NAME组移植瘤VEGF蛋白的表达(113.14±2.34), 与对照组(98.56±1.76)相比, 明显减弱(P<0.05).
结论: L-NAME具有抑制肿瘤新生血管生成的作用, 可抑制大肠癌裸鼠移植瘤的生长; 和5-FU联合具有协同抗肿瘤作用.
引文著录: 孙文洲, 于丽波, 董新舒. 一氧化氮合酶抑制剂对大肠癌裸鼠移植瘤的抗血管生成作用. 世界华人消化杂志 2007; 15(2): 114-117
Revised: October 12, 2006
Accepted: October 14, 2006
Published online: January 18, 2007
AIM: To investigate the anti-angiogenic effect of NG-nitro-L-arginine methyl ester (L-NAME), an inhibitor of nitric oxide synthase on the growth of colorectal cancer xenografts in nude mice.
METHODS: The xenografts derived from colorectal carcinoma cells LS174 were inoculated in nude mice, and then the mice were randomly divided into group A, B, C and D, intragastrically treated with normal saline (n = 6, 0.2 mL), L-NAME (n = 6, 1.5 mg/kg), 5-fluorouracil (5-FU, n = 6, 5 mg/kg), and L-NAME plus 5-FU (L-NAME 1.5 mg/kg, 5-FU 5 mg/kg), respectively, for 2 weeks (three times per week). Tumor volume was measured in nude mice bearing xenografts. The microvessel density (MVD) was determined by immunohistochemistry, and the protein level of vascular endothelial growth factor (VEGF) was detected by Western blot.
RESULTS: The tumor inhibition rates were significantly higher in group B, C, and D than that in group A (34.1%, 46.0%, 74.1% vs 0, P < 0.01). There was significant difference between group B and D as well as between group C and D (P < 0.01). The value of MVD in group A was 28.9 ± 2.7, markedly higher than that in group B (16.2 ± 3.1) (P < 0.05). The level of VEGF protein was also decreased in group B as compared with that in group A (98.56 ± 1.76 vs 113.14 ± 2.34, P < 0.05).
CONCLUSION: L-NAME may restrain the growth of human colorectal carcinoma LS174 xenografts by inhibiting the angiogenesis in nude mice. L-NAME in combination with 5-FU may produce a synergetic effect.
- Citation: Sun WZ, Yu LB, Dong XS. Anti-angiogenic effect of nitric oxide synthase inhibitor on colorectal cancer xenografts in nude mice. Shijie Huaren Xiaohua Zazhi 2007; 15(2): 114-117
- URL: https://www.wjgnet.com/1009-3079/full/v15/i2/114.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v15.i2.114
一氧化氮(NO)与肿瘤的发生、发展及肿瘤的恶性程度密切相关[1-4], 关于N-硝基精氨酸甲酯(L-NAME)可抑制肿瘤的生长的研究国外报道较少[5-7], 其作用机制尚不十分清楚[8], 国内尚未见报道. 我们拟采用裸鼠移植瘤模型, 观察一氧化氮合酶(NOS)抑制剂L-NAME对人大肠癌移植瘤内肿瘤新生血管生成及肿瘤细胞的抑制作用.
人大肠中、低分化型腺癌细胞系LS174T, 具有较高的侵袭能力, 由哈尔滨医科大学肿瘤研究所提供, RPMI1640培养基、新生牛血清、胰蛋白酶购自杭州四季青生物工程公司. 细胞常规培养于用含100 mL/L灭活小牛血清、100 kU/L青链霉素的RPMI-1640培养液中, 培养条件为37 ℃, 50 mL/L CO2孵箱单层传代培养, 细胞换液时间1-3 d, 传代3-5 d. BALB/c(nu/nu)裸鼠20只, 6-8 wk, 体质量18-22 g, ♂♀不分, 购自北京市维通利华实验动物技术有限公司, 在SPF级下无菌饲养室饲养. L-NAME购自Sigma公司.
实验前观察1 wk, 若裸鼠正常, 收集对数生长期细胞, 生理盐水制成悬液用1.0 mL注射器将0.2 mL细胞悬液(约2.0×106细胞)注入裸鼠右后肢外侧皮下. 待移植瘤肉眼可见时, 按数字随机法分组, 每组6只. 对照组: 生理盐水0.2 mL灌胃; L-NAME组: L-NAME 1.5 mg/kg; 5-FU组: 5-FU 5 mg/kg; L-NAME+5-FU联合组: L-NAME 1.5 mg/kg +5-FU 5 mg/kg皆灌胃. 3次/wk, 共2 wk. 定期观察小鼠的饮食、精神、排便情况, 称量裸鼠体质量, 用游标卡尺测量肿瘤结节的长径、短径, 肿瘤体积V = 1/2长径×短径2. 体积抑瘤率 = (1-实验组体积/对照组体积)×100%. 1 mo后处死裸鼠, 取下肿瘤组织, 按公式质量抑瘤率 = (1-实验组瘤质量/对照组瘤质量)×100%.
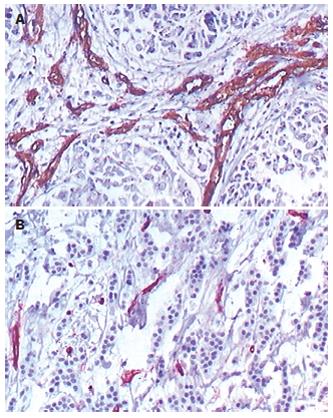
1.2.1 肿瘤组织微血管密度(MVD)的检测: 将肿瘤剪切成0.4 cm×0.3 cm×0.3 cm大小, 置于40 g/L中性甲醛中固定, 常规石蜡切片, 切片厚4 mm, HE染色, 光镜观察. 免疫组化检测肿瘤组织微血管密度, 鼠抗人CD34 mAb购于北京中山生物技术有限公司. 采用S-P法, 按试剂盒说明书逐步操作. 用已知阳性切片作阳性对照, 用PBS替代一抗作阴性对照. 肿瘤微血管密度测定参照Weidner方法: 凡是染成棕黄色单个内皮细胞或内皮细胞簇均作为一个血管计数, 凡管腔大于8个红细胞大小、带有较厚肌层的血管区域的血管均不计数. 先用低倍镜选取5个血管密度高的区域, 再转到高倍镜下计数每个区域微血管数量, 以其平均值作为每例的MVD.
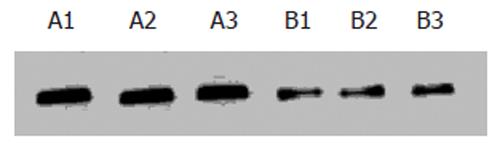
1.2.2 裸鼠肿瘤组织VEGF蛋白表达: 取对照组和LNAME处理组裸鼠移植瘤组织, 用预冷的PBS洗2次, 剪碎、匀浆, 加入细胞裂解液, 4℃裂解20 min, 收集细胞裂解液, 离心, 收集上清液. 用Bradford法测定裂解液中总蛋白含量. 取40 g蛋白加入上样缓冲液, 95℃加热10 min, Western blot方法参考分子克隆实验指南. 120 g/L SDS.PAGE电泳分离后, 电转移至PVDF膜上, 50 g/L脱脂牛奶封闭后加入第一抗体于4℃温育2 h, PBS洗涤3次, 每次10 min. 加入第二抗体于室温孵育l h, 再用PBS洗3次, 每次10 min, 加入化学发光剂(ECL), 放人暗盒中并压片, 2-5 min后显影、定影.
统计学处理 所有数据采用均数+标准差表示, 数据采用SPSS10.0 统计软件分析, 计量资料分析采用t检验, 检验水准α = 0.05.
对照组肿瘤体积17 d后增长明显, L-NAME组和5-FU组上升缓慢, 而联合治疗组17 d后肿瘤生长几乎处于停滞状态, 体积无明显变化(图1). 实验结束时各组间鼠质量无显著性差异, 与实验前相比体质量改变也不明显. 在瘤质量方面: 各治疗组与对照组比较差异显著(P<0.01); 联合治疗组与L-NAME组、5-FU组相比, 差异也有显著性(P<0.01). 在肿瘤体积方面: 各治疗组与对照组比较, 差异有显著性(P<0.01), 联合治疗组与L-NAME组、5-FU组比较, 差异也有显著性(P<0.01)(表1).
抗CD34抗体染色阳性的肿瘤组织新生血管内皮细胞被染成棕黄色, 癌组织内微血管形态不规则, 部分血管无明显管腔,表现为内皮细胞簇, 新生血管可分布在肿瘤任何位置(图2). MVD值对照组为28.94±2.67, L-NAME组为16.17±3.14与对照组比较, 差异有显著性(P<0.05).
Western blot分析结果显示, L-NAME能明显抑制LS174T细胞裸小鼠移植瘤VEGF蛋白的表达, 与对照组相比, 都明显减弱(P<0.05, 图3).
NO在肿瘤生物学中具有复杂的双向作用, 适宜的低浓度NO可以促进肿瘤生长和转移, 而高浓度NO则可以引起组织细胞的致死性损害. NOS是生物体内NO合成的关键限速酶, 因此内源性NO量的改变必然伴随NOS活性或表达的变化. 上述结果显示, NO在肿瘤进展中起促进作用, NOS可以作为干预肿瘤形成药物的标靶, NOS抑制剂则可以作为潜在的抗肿瘤药物. Kojima et al[9]研究结果显示, 与非肿瘤组织比较, 肿瘤组织中iNOS mRNA表达显著提高, iNOS蛋白在肿瘤组织中也有强表达. 徐梅华 et al[10]研究了62例大肠癌NOS的表达及其与大肠癌发生、发展的关系, 结果显示, iNOS在大肠癌组织中阳性或强阳性表达, 而正常的大肠黏膜及癌旁组织iNOS阴性表达. Ahn et al[11]发现, iNOS活性高的人群其癌细胞更具有侵袭性, 肿瘤转移率高, 5 a生存率低, 提示iNOS与大肠癌的发生、发展、预后密切相关. 我们成功建立了裸鼠皮下移植瘤模型后, 给予裸鼠不同药物干预, 结果表明, 各治疗组与对照组比较, 差异有显著性. 联合治疗组抑瘤效果明显强于前两者. 这表明L-NAME与5-FU联合应用具有协同作用, 可明显提高5-FU抗瘤效应. 肿瘤内部血管分布不均匀, 任何一点难以代表整个肿瘤血管生成情况. 我们取瘤组织典型区域多个视野血管平均值作为微血管密度值可减少偏差, 基本上能代表肿瘤微血管生成的实际水平. CD34抗原因子是公认的特异血管标记物, 阳性率可靠, 因而本实验结果可靠性较好. MVD检测结果进一步表明, 对照组标本可见到有大量血管生成, L-NAME组新生血管明显减少, 这样移植瘤无法获得足够养料, 生长受到明显限制, 而且瘤细胞不能通过血液循环发生远处转移. VEGF是目前己知最强的直接作用于血管内皮细胞的生长因子, 常见恶性肿瘤均有VEGF的过量表达, 并与患者的预后和微血管密度密切相关. 我们研究结果表明, L-NAME可以降低VEGF的蛋白水平, 这样可以抑制血管内皮细胞的增殖、迁移, 进而抑制血管生成[12]. 瘤块能继续缓慢生长, 可能原因有: (1)肿瘤细胞还存在其他血管生成相关因子, 以及其他促进血管生成的途径; (2)与用药周期、药物的半哀期和用药方法有一定关系. 提示临床上应该早期发现和确诊肿瘤, 早期积极手术切除肿瘤, 接下来积极应用抗血管生成药物, 联合应用化疗药物, 这样既可能完全杀死瘤细胞, 又能抑制肿瘤新生血管的生成, 最终达到提高肿瘤治愈率, 甚至根除肿瘤的目的. 对于中晚期肿瘤患者, 手术切除病灶, 再辅以化疗或放疗尽可能最大程度上杀灭残余或远处转移的瘤细胞, 在此基础上, 应用抗血管生成药物可以明显降低肿瘤复发和转移的发生率.
通过本实验, 我们认为, L-NAME可抑制肿瘤的血管生成, 进而阻断肿瘤转移, 使用安全, 应用范围广. NOS可以作为干预肿瘤血管形成药物靶点, L-NAME可以作为潜在的抗肿瘤血管药物, 具有重要临床应用前景.
大肠癌是人类最常见的恶性肿瘤之一, 其发病率和死亡率呈逐年增高的趋势, 一氧化氮与大肠癌发生、发展, 包括肿瘤血管生成有密切关系, 以一氧化氮为靶点利用一氧化氮抑制剂N-硝基精氨酸甲酯抑制肿瘤生长的研究报道较少, 其作用机制尚需进一步探讨.
本研究结果表明一氧化氮合酶抑制剂具有抑制肿瘤新生血管生成的作用, 可抑制大肠癌裸鼠移植瘤的生长, 为其今后用于临床治疗提供了理论与实验基础.
论文选题实用, 文题对应, 摘要简练, 方法路线可行, 结论合理.
| 1. | Barreiro Arcos ML, Gorelik G, Klecha A, Goren N, Cerquetti C, Cremaschi GA. Inducible nitric oxide synthase-mediated proliferation of a T lymphoma cell line. Nitric Oxide. 2003;8:111-118. [PubMed] [DOI] |
| 2. | Lala PK, Chakraborty C. Role of nitric oxide in carcinogenesis and tumour progression. Lancet Oncol. 2001;2:149-156. [PubMed] [DOI] |
| 3. | Niu XJ, Wang ZR, Wu SL, Geng ZM, Zhang YF, Qing XL. Relationship between inducible nitric oxide synthase expression and angiogenesis in primary gallbladder carcinoma tissue. World J Gastroenterol. 2004;10:725-728. [PubMed] [DOI] |
| 4. | Li LG, Xu HM. Inducible nitric oxide synthase, nitrotyrosine and apoptosis in gastric adenocarcinomas and their correlation with a poor survival. World J Gastroenterol. 2005;11:2539-2544. [PubMed] [DOI] |
| 5. | Orucevic A, Lala PK. NG-nitro-L-arginine methyl ester, an inhibitor of nitric oxide synthesis, ameliorates interleukin 2-induced capillary leakage and reduces tumour growth in adenocarcinoma-bearing mice. Br J Cancer. 1996;73:189-196. [PubMed] [DOI] |
| 6. | Orucevic A, Lala PK. Effects of N(G)-Nitro-L-arginine methyl ester, an inhibitor of nitric oxide synthesis, on IL-2-induced LAK cell generation in vivo and in vitro in healthy and tumor-bearing mice. Cell Immunol. 1996;169:125-132. [PubMed] [DOI] |
| 7. | Yu LB, Dong XS, Sun WZ, Zhao DL, Yang Y. Effect of a nitric oxide synthase inhibitor NG-nitro-L-arginine methyl ester on invasion of human colorectal cancer cell line SL-174T. World J Gastroenterol. 2005;11:6385-6388. [PubMed] [DOI] |
| 8. | Uneda S, Hata H, Matsuno F, Nagasaki A, Harada N, Mitsuya Y, Matsuzaki H, Mitsuya H. A nitric oxide synthase inhibitor, N(G)-nitro-l-arginine-methyl-ester, exerts potent antiangiogenic effects on plasmacytoma in a newly established multiple myeloma severe combined immunodeficient mouse model. Br J Haematol. 2003;120:396-404. [PubMed] [DOI] |
| 9. | Kojima M, Morisaki T, Tsukahara Y, Uchiyama A, Matsunari Y, Mibu R, Tanaka M. Nitric oxide synthase expression and nitric oxide production in human colon carcinoma tissue. J Surg Oncol. 1999;70:222-229. [PubMed] [DOI] |
| 11. | Ahn B, Ohshima H. Suppression of intestinal polyposis in Apc(Min/+) mice by inhibiting nitric oxide production. Cancer Res. 2001;61:8357-8360. [PubMed] |
| 12. | Watanabe K, Kawamori T, Nakatsugi S, Wakabayashi K. COX-2 and iNOS, good targets for chemoprevention of colon cancer. Biofactors. 2000;12:129-133. [PubMed] [DOI] |
电编: 李琪 编辑: 潘伯荣