修回日期: 2006-09-17
接受日期: 2006-09-29
在线出版日期: 2006-12-08
目的: 研究选择性环氧合酶-2(COX-2)抑制剂Celecoxib对人胃癌细胞株SGC7901凋亡的影响.
方法: 采用MTT法测定人胃癌细胞株SGC7901分别在1×10-5, 1×10-6, 1×10-7, 1×10-8, 1×10-9 mol/L的Celecoxib作用48h后生长抑制情况; 流式细胞术(FCM)观察Celecoxib 对SGC7901细胞凋亡的影响; 采用免疫细胞化学染色观察Survivin的表达.
结果: Celecoxib浓度为1×10-5-1×10-9 mol/L时, 对SGC7901细胞的生长均有抑制作用, 以1×10-5 mol/L浓度的抑制作用最为显著, 其抑制率为30.03%; 1×10-5 mol/L Celecoxib作用12, 24, 48 h 后, 细胞凋亡比例较对照组均明显增加, 48 h凋亡率达17.83%; 1×10-5 mol/L Celecoxib作用后, Survivin的表达自用药3 h起下降, 24 h 最明显.
结论: Celecoxib可诱导SGC7901细胞的凋亡, 其可能的作用机制为抑制细胞Survivin基因的表达.
引文著录: 凌桂琴, 王绪, 王琳, 李小翠. Celecoxib对胃癌细胞凋亡的影响. 世界华人消化杂志 2006; 14(34): 3302-3305
Revised: September 17, 2006
Accepted: September 29, 2006
Published online: December 8, 2006
AIM: To explore the effect of Celecoxib (cyclooxygenase-2 inhibitor) on the apoptosis of gastric cancer cell line SGC7901 in vitro.
METHODS: After gastric cancer cell line SGC7901 was treated with Celecoxib (1×10-5 to 1 ×10-9 mol/L) for 24 h, the proliferration of cells was detected by MTT assay. Flow cytometry (FCM) was used to measure the apoptosis of SGC7901 cells, and immunocytochemistry was used to observe the expression of Survivin.
RESULTS: Celecoxib inhibited the proliferation of SGC7901 cells at the concentrations of 1×10-5 to 1×10-9 mol/L, and the maximal inhibitory rate was 30.03%, which was produced by 1×10-5 mol/L Celecoxib. After SGC7901 cells were treated with 1×10-5 mol/L Celecoxib for 12, 24, 48 h, the proportions of apoptosis cells were significantly increased in comparison with those of the control cells, and the apoptosis rate was 17.83% after 48 h. The expression of Survivin was decreased at 3 and 24 h, especially at 24 h.
CONCLUSION: Celecoxib can induce the apoptosis of gastric cancer cell line SGC7901 by suppressing the expression of Survivin.
- Citation: Ling GQ, Wang X, Wang L, Li XC. Effect of Celecoxib on apoptosis of human gastric cancer cell line. Shijie Huaren Xiaohua Zazhi 2006; 14(34): 3302-3305
- URL: https://www.wjgnet.com/1009-3079/full/v14/i34/3302.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i34.3302
环氧合酶(cyclooxygenase, COX)是前列腺素合成过程中重要的限速酶. COX存在两个异构体: COX-1和COX-2. COX-1被认为是"看家基因", 定位于内质网, 参与维持机体正常的生理机能; COX-2被认为是"快速反应基因", 定位于核膜和内质网, 参与多种病理生理过程[1]. 近年来流行病学、动物学实验以及细胞学实验等多方面的研究表明, COX-2在多种肿瘤中普遍存在过度表达现象, COX-2表达量为基础表达量的20-80倍, 而COX-1的表达量基本不变[2], Celecoxib是美国食品与药品管理局(FDA)批准上市的第一个COX-2选择性抑制剂, 在很多动物肿瘤模型中显示出抑瘤作用[3-4]. 本实验旨在观察Celecoxib 对体外培养的胃癌细胞株SGC7901 凋亡的影响及其机制.
人胃腺癌细胞株SGC7901购自中科院上海细胞生物学研究所. Celecoxib为辉瑞制药有限公司产品; RPMI1640培养基、胰蛋白酶为Gibco 公司产品; MTT, DMSO, PI, RNA酶为Sigma公司产品; 小牛血清为杭州四季青生物工程材料有限公司产品; 鼠抗人Survivin mAb为NeoMarkers公司产品.
细胞培养人胃癌细胞株SGC7901生长于含100 mL/L小牛血清的RPMI1640 培养基中, 内加青霉素100 mg/L , 链霉素100 mg/L, 37 ℃, 50 mL/L CO2浓度及饱和湿度条件下常规培养, 细胞呈单层贴壁生长, 每3-4 d传代一次, 传代时用2.5 g/L胰蛋白酶-0.2 g/L EDTA 1:1 消化液消化3-5 min .
1.2.1 MTT比色分析法: 选择指数生长期的SGC7901细胞, 2.5 g/L胰蛋白酶-0.2 g/L EDTA 1:1消化, 以RPMI1640培养基调整细胞悬液浓度为1×108/L, 接种于96 孔板, 每孔接种100 mL, 另加培养基100 mL. 37 ℃, 50 mL/L CO2条件下培养24 h后, 更换无血清培养基继续培养24 h. 吸去上清液, 分组: 设空白组(不加细胞)、对照组(不加药)、Celecoxib 组(分为10-5, 10-6, 10-7, 10-8, 10-9 mol/L 5个浓度段), 每组6个复孔. 继续培养48 h, 每24 h更换新鲜培养基和药物. 终止培养前4 h加入MTT 40 mL/孔, 使MTT终浓度为1 g/L, 避光孵育. 结束培养时, 吸去全部上清液, 加入DMSO 150 mL/孔, 微孔板震荡器震荡10 min使MTT结晶物充分溶解, 以只加培养液不加细胞的空白对照孔调零, 酶联检测仪上测定吸光度A值(l = 492 nm). 按下列公式计算细胞生长抑制率: 抑制率= [(对照组A-空白组A)-(实验组A-空白组A)]/(对照组A-空白组A)×100%.
1.2.2 流式细胞仪测定细胞凋亡: 取指数生长期的SGC7901细胞, 2.5 g/L胰蛋白酶-0.2 g/L EDTA 1:1消化, 以RPMI1640培养基调整细胞浓度为4×108/L, 接种于50 mL培养瓶, 每瓶4 mL. 37 ℃, 50 mL/L CO2培养24 h后分组. 设0 h对照, 12, 24, 48 h组, 各组分别设对照(不加药)、Celecoxib组(药物终浓度以MTT法结果最佳作用浓度为准). 每天更换含新鲜Celecoxib的培养基. 培养结束, 吸去上清, 加2.5 g/L胰蛋白酶-0.2 g/L EDTA 1:1 消化, 1000 r/min离心10 min收集细胞, 700 mL/L 冷乙醇1 mL 固定细胞, 过夜后上机检测.
1.2.3 免疫细胞化学染色: 选择指数生长期的SGC7901细胞, 2.5 g/L胰蛋白酶-0.2 g/L EDTA 1:1消化, 制成单细胞悬液, 接种于内置玻片的15 cm培养皿, 37 ℃, 50 mL/L CO2条件下培养, 至70%细胞发生融合时分组: 对照组(不加药)、Celecoxib组(药物终浓度以MTT法结果最佳作用浓度为准), 分别于3, 6, 12, 24 h终止培养, 取出玻片, PBS简单冲洗, 950 mL/L乙醇固定10 min, 按SP试剂盒说明染色. 阳性细胞为胞质出现棕黄色至深棕黄色颗粒. 每次实验均设不加一抗(PBS代替一抗)的阴性对照, 用已知阳性切片作阳性对照. Survivin表达定位于细胞质. 结果应用Leica Qwin计算机图像分析仪, 随机选取100个细胞, 测其细胞灰阶度, 以反应染色强度, 比较各组染色强度差异.
统计学处理 实验数据以mean±SD表示, 采用Stata 7.0统计软件的单因素方差分析, 以P< 0.05为有统计学意义.
1×10-9-1×10-5 mol/L的Celecoxib对SGC7901细胞的增殖均有抑制作用, Celecoxib对SGC7901细胞株的抑制作用, 随浓度增高而增强. 10-9mol/L 的Celecoxib对细胞的增殖抑制作用无明显增加(P>0.05). 在1×10-8-1×10-5 mol/L之间, 各浓度组间比较亦有显著性差异(P<0.05, 表1).
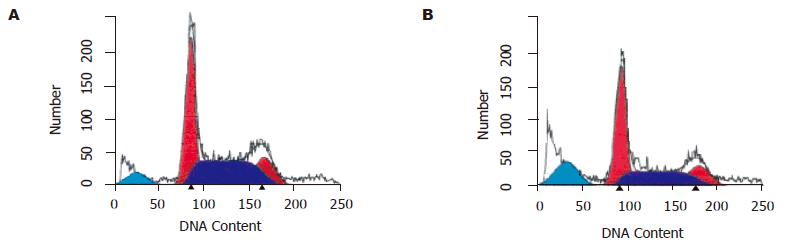
SGC7901细胞在正常状况下, 凋亡率较低. 细胞经Celecoxib作用后, 12 h时凋亡比例即明显增加, 与对照组相比差异有显著性(P<0.01). 随着时间延长, 凋亡比例亦升高(表2, 图1).
SGC7901细胞Survivin基因呈阳性表达, 细胞经Celecoxib作用后, Survivin基因的表达自用药3 h起有下降, 24 h最明显(图2), 但只有24 h 组与对照组比较有显著性差异(P<0.05).
近年来的研究发现, 多种肿瘤中COX-2高表达, 并且其与肿瘤的发生、发展有着较为密切的关系, 而抑制COX-2表达有可能预防和逆转肿瘤的发生, 表明COX-2在肿瘤的发生、发展过程中起重要作用, COX-2选择性抑制剂正被试图用作化学治疗和化学预防药物. COX-2选择性抑制剂Celecoxib在很多动物模型中抑制肿瘤的发生: 在偶氮甲烷所致的鼠大肠癌模型中, Celecoxib 可使大肠癌的发生率和肿瘤数量分别减少93% 和97%, 并抑制异常结肠腺管灶的形成[3]. 在体外培养细胞中, 研究发现Celecoxib对肝癌HepG2细胞株[5]及SMMC-7721细胞株[6]、结肠癌细胞株HT-29[7], 均有程度不同的抑制率. 但是Celecoxib抑制肿瘤发生的机制目前还不十分清楚, 这种作用可涉及多方面: 如抑制肿瘤血管的形成[8], 抑制肿瘤细胞增殖, 诱导肿瘤细胞亡, 对磷酸化ERK2表达的影响[9], 并有可能逆转肿瘤消耗引起的消瘦而对正常细胞的结构、凋亡无明显影响[10].
本实验采用MTT比色分析法测定Celecoxib对体外SGC7901细胞生长的影响. Celecoxib作用48 h后, SGC7901细胞的生长有明显的抑制. 在10-5-10-9mol/L浓度范围内具有浓度依赖性, 对癌细胞的抑制作用随浓度的增高而增高, 各浓度组间有明显差异(P<0.05), 10-5 mol/L 浓度时, 抑制率达到30.03% .
调节细胞凋亡的基因参与了肿瘤的发生、发展过程, 主要与3个基因家族关系密切, 即Bcl-2家族、Caspase家族和IAP(inhibition of apoptosis protein, 凋亡蛋白抑制因子)家族[11], IAPs是继Bcl-2家族之后发现的又一个抗凋亡基因家族, Survivin是IAP家族的新成员, 定位于人染色体17q25上, 1997年由Ambrosini et al[12]利用效应细胞蛋白酶受体1CDNA在人基因组文库中筛选克隆出来, 与IAPS家族其他成员不同, Survivin基因只表达于胚胎组织和恶性肿瘤组织[13-14], 而在正常分化的成人组织中无表达. 研究发现, Survivin与恶性肿瘤的发生、发展关系密切, 是迄今为止发现的最强的调亡抑制因子. Survivin的表达与多种肿瘤的生物学和(或)疾病分期有关[15], 在宫颈癌, 临床分期越晚, 组织分级恶性度越高, Survivin基因阳性表达率越高, 说明Survivin基因阳性表示着不良预后. 本研究中发现, SGC7901细胞Survivin表达阳性. Celecoxib作用后, 与对照组相比, Survivin表达早期即下降, 但只有作用24 h后与对照组比较才有统计意义(P<0.05), 与本研究中发现Celecoxib作用后, 12 h凋亡比例即明显增加不相符, 其可能原因为: 由于胃癌细胞中影响凋亡的因素太多, 可能前期有别的凋亡抑制基因如Bcl-2等作用增强, 导致Survivin的作用被掩盖. 这提示在胃癌进展过程中还受其他癌基因的调控, 是多基因参与, 多因素作用的结果, Survivin基因与其他癌基因的关系有待进一步研究.
本实验发现, Celecoxib对胃癌细胞SGC7901 的生长有抑制作用, 并且诱导细胞凋亡是其作用机理之一; 同时, 研究表明, Celecoxib与化疗药物合用可增强肿瘤细胞对化疗药物的敏感性[16]以及对放疗的敏感性[17], 因此有望成为胃癌的新一类的辅助治疗方法.
胃癌是严重危害人类健康和生命的常见恶性肿瘤之一, 患者5 a生存率徘徊在20%-30%,有必要寻求新的治疗靶点以提高胃癌患者的生存率. COX-2选择性抑制剂Celecoxib对胃癌生长的高效抑制及低副反应使其用于肿瘤临床治疗成为可能.
肿瘤不仅是细胞增殖异常性疾病, 同时也是细胞凋亡异常性疾病, Survivin是迄今为止发现的最强凋亡抑制因子, 其表达的组织特异性及功能的多样性, 使其成为肿瘤研究领域的一个新热点.
本文发现Celecoxib可通过诱导细胞凋亡来抑制肿瘤细胞生长, 但本研究尚处于体外实验阶段, Celecoxib的体内作用及对其他基因有无调控作用等均有待进一步的深入研究.
| 1. | Romano M, Ricci V, Memoli A, Tuccillo C, Di Popolo A, Sommi P, Acquaviva AM, Del Vecchio Blanco C, Bruni CB, Zarrilli R. Helicobacter pylori up-regulates cyclooxygenase-2 mRNA expression and prostaglandin E2 synthesis in MKN 28 gastric mucosal cells in vitro. J Biol Chem. 1998;273:28560-28563. [PubMed] [DOI] |
| 2. | Masferrer JL, Leahy KM, Koki AT, Zweifel BS, Settle SL, Woerner BM, Edwards DA, Flickinger AG, Moore RJ, Seibert K. Antiangiogenic and antitumor activities of cyclooxygenase-2 inhibitors. Cancer Res. 2000;60:1306-1311. [PubMed] |
| 3. | Jacoby RF, Cole CE, Tutsch K, Newton MA, Kelloff G, Hawk ET, Lubet RA. Chemopreventive efficacy of combined piroxicam and difluoromethylornithine treatment of Apc mutant Min mouse adenomas, and selective toxicity against Apc mutant embryos. Cancer Res. 2000;60:1864-1870. [PubMed] |
| 4. | Gupta RA, Dubois RN. Colorectal cancer prevention and treatment by inhibition of cyclooxygenase-2. Nat Rev Cancer. 2001;1:11-21. [PubMed] [DOI] |
| 8. | Gately S. The contributions of cyclooxygenase-2 to tumor angiogenesis. Cancer Metastasis Rev. 2000;19:19-27. [PubMed] [DOI] |
| 10. | Davis TW, Zweifel BS, O'Neal JM, Heuvelman DM, Abegg AL, Hendrich TO, Masferrer JL. Inhibition of cyclooxygenase-2 by celecoxib reverses tumor-induced wasting. J Pharmacol Exp Ther. 2004;308:929-934. [PubMed] [DOI] |
| 11. | Conway EM, Pollefeyt S, Steiner-Mosonyi M, Luo W, Devriese A, Lupu F, Bono F, Leducq N, Dol F, Schaeffer P. Deficiency of survivin in transgenic mice exacerbates Fas-induced apoptosis via mitochondrial pathways. Gastroenterology. 2002;123:619-631. [PubMed] [DOI] |
| 12. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 13. | Kania J, Konturek SJ, Marlicz K, Hahn EG, Konturek PC. Expression of survivin and caspase-3 in gastric cancer. Dig Dis Sci. 2003;48:266-271. [PubMed] [DOI] |
| 14. | Grabowski P, Kuhnel T, Muhr-Wilkenshoff F, Heine B, Stein H, Hopfner M, Germer CT, Scherubl H. Prognostic value of nuclear survivin expression in oesophageal squamous cell carcinoma. Br J Cancer. 2003;88:115-119. [PubMed] [DOI] |
| 15. | Altieri DC, Marchisio PC. Survivin apoptosis: an interloper between cell death and cell proliferation in cancer. Lab Invest. 1999;79:1327-1333. [PubMed] |
| 16. | Hida T, Kozaki K, Muramatsu H, Masuda A, Shimizu S, Mitsudomi T, Sugiura T, Ogawa M, Takahashi T. Cyclooxygenase-2 inhibitor induces apoptosis and enhances cytotoxicity of various anticancer agents in non-small cell lung cancer cell lines. Clin Cancer Res. 2000;6:2006-2011. [PubMed] |
| 17. | Nakata E, Mason KA, Hunter N, Husain A, Raju U, Liao Z, Ang KK, Milas L. Potentiation of tumor response to radiation or chemoradiation by selective cyclooxygenase-2 enzyme inhibitors. Int J Radiat Oncol Biol Phys. 2004;58:369-375. [PubMed] [DOI] |
电编: 李琪 编辑:张焕兰