修回日期: 2006-08-12
接受日期: 2006-09-01
在线出版日期: 2006-11-18
目的: 研究主要5-HT受体亚型在慢传输型便秘(slow transit constipation, STC)患者结肠中的表达, 探讨其在慢传输型便秘发病机制中的作用.
方法: 采用免疫组化EnVision法, 检测20例STC患者和20例对照组结肠组织中5-HT1A, 5-HT3和5-HT4受体的分布及表达水平, 并采用IMS计算机辅助图像分析系统进行半定量分析.
结果: 5-H1A受体分布于黏膜下层、肌层, 肌间神经丛5-HT1A受体的表达在STC组和对照组间无显著差异(P = 0.548). 5-HT3受体分布于黏膜下层和肌层, 肌间神经丛STC组阳性指数显著低于对照组(65.2±15.9 vs 94.3±20.1, P<0.01). 5-HT4受体分布于黏膜层、黏膜下层、肌层. 在黏膜层和肌间神经丛, STC组5-HT4受体阳性指数均显著低于对照组(57.8±10.9 vs 78.5±12.9, P<0.01; 77.5±19.9, 119.2±26.9, P<0.01). STC组中, 5-HT3受体表达水平与结肠传输试验第5天体内残留标志物数量无关(P>0.05); 但5-HT4受体表达水平与第5天体内残留标志物数量呈负相关(r = -0.782, P < 0.01).
结论: STC患者结肠中存在5-HT3和5-HT4受体亚型的表达下调, 两者可能参与了STC的发病机制.
引文著录: 丁健华, 赵荣华, 傅传刚, 毕丽霞, 孟荣贵, 喻德洪. 慢传输型便秘患者结肠中五羟色胺受体亚型的表达及意义. 世界华人消化杂志 2006; 14(32): 3111-3115
Revised: August 12, 2006
Accepted: September 1, 2006
Published online: November 18, 2006
AIM: To investigate the expression of serotonin receptor subtypes in the colon of patients with slow transit constipation (STC), and explore its role in the pathogenesis of STC.
METHODS: Using Envision immunohistochemical staining, we detected the expression and distribution of 5-HT1A receptor, 5-HT3 receptor and 5-HT4 receptor in the colon of 20 STC patients and 20 controls. IMS computer analysis system was used for semi-quantitative analysis.
RESULTS: 5-HT1A receptor was positively scattered in submucosa and muscular layer. The positive score in myenteric plexus had no significant difference between two groups (P = 0.548). 5-HT3 receptor was also positively scattered in submucosa and muscular layer. The positive score in myenteric plexus was significantly lower in STC group than that in the controls (65.2 ± 15.9 vs 94.3 ± 20.1, P < 0.01). 5-HT4 receptor was positively scattered in mucosa, submucosa and muscular layer. In mucosa and myenteric plexus, the positive scores in STC group were significantly lower than those in the controls (57.8 ± 10.9 vs 78.5 ± 12.9, P < 0.01; 77.5 ± 19.9 vs 119.2 ± 26.9, P < 0.01). In STC patients, we didn't find any correlation between the expression level of 5-HT3 receptor and the remained marks at the 5th day of colonic transit study. However, there was a negative correlation between the expression level of 5-HT4 receptor and the remained marks at the 5th day of colonic transit study (r = -0.782, P < 0.01).
CONCLUSION: The expression levels of 5-HT3 and 5-HT4 receptors are decreased in the colon of STC patients, which may contribute to the pathogenesis of STC.
- Citation: Ding JH, Zhao RH, Fu CG, Bi LX, Meng RG, Yu DH. Expression of serotonin receptor subtypes and its significance in the colon of patients with slow transit constipation. Shijie Huaren Xiaohua Zazhi 2006; 14(32): 3111-3115
- URL: https://www.wjgnet.com/1009-3079/full/v14/i32/3111.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i32.3111
慢传输型便秘(slow transit constipation, STC)是由结肠传输功能障碍引起的一种常见疾病, 表现为排便次数减少、排便困难、腹胀等. 近年来, 一些研究分别从电生理学、组织学和胃肠神经内分泌学等方面对其发病机制进行了探讨, 但其确切发病机制尚不清楚[1-3]. 五羟色胺(serotonin, 5-HT)是参与调节胃肠道运动和分泌功能的重要神经递质. 我们最近的研究发现, STC患者结肠中, 5-HT及总5-HT受体的表达均存在异常[4-5]. 由于5-HT受体包括多种亚型, 功能不同, 因此, 需要进一步对5-HT各受体亚型进行研究, 以深入探讨5-HT信号系统在STC发病机制中的作用. 我们对分布于肠神经元上的兴奋性5-HT3受体、5-HT4 受体和抑制性5-HT1A受体在STC患者结肠中的表达进行了研究.
我院2001-03/2004-12经结肠传输实验证实为STC患者, 行次全结肠切除术的石蜡标本20例. 男6例, 女14例, 平均年龄46.5(18-70)岁. 对照组: 取我院2004-06/2004-12因升结肠癌行右半结肠切除的石蜡标本10例, 因直肠癌或乙状结肠癌行部分左半结肠切除的石蜡标本10例, 均取距肿瘤5 cm以上的正常组织. 所有对照组患者术前无排便困难或其他胃肠道功能性疾病史, 男9例, 女11例, 平均年龄58.7(24-76)岁. 两组在性别和年龄构成上差异无统计学意义(P>0.05). 蜡块常规切片厚4 μm. 兔抗人5-HT1A, 3, 4 受体的多克隆抗体购自美国Santa Cruz公司, 即用型EnVision试剂盒购自丹麦DaKo公司, DAB显色剂购自北京中杉试剂公司.
采用免疫组化EnVision法染色, 组织切片常规脱蜡至水后, 微波95 ℃ 10 min×2抗原修复, 3 mL/L H2O2抑制内源性过氧化物酶20 min, 再滴入相应一抗37 ℃ 1 h, 加入EnVision试剂37 ℃ 30 min, DAB显色后苏木素复染, 常规封片. 镜检阳性染色呈棕黄色颗粒. 阴性对照以PBS代替相应一抗. 采用IMS细胞图像分析系统进行计算机辅助半定量分析, 光镜下以目标区域为中心, 每张切片随机选取5个视野摄入计算机, 分别测定阳性区域面积比和光密度值(A), 计算阳性指数(阳性面积比×光密度值×100), 最后计算平均值.
统计学处理 采用SPSS 10.0分析软件进行统计学处理. 均数间的比较用t检验, 方差不齐者采用Wilcoxon秩和检验, 5-HT受体与结肠传输时间的关系采用Spearman等级相关分析. P<0.05为差异有显著性.
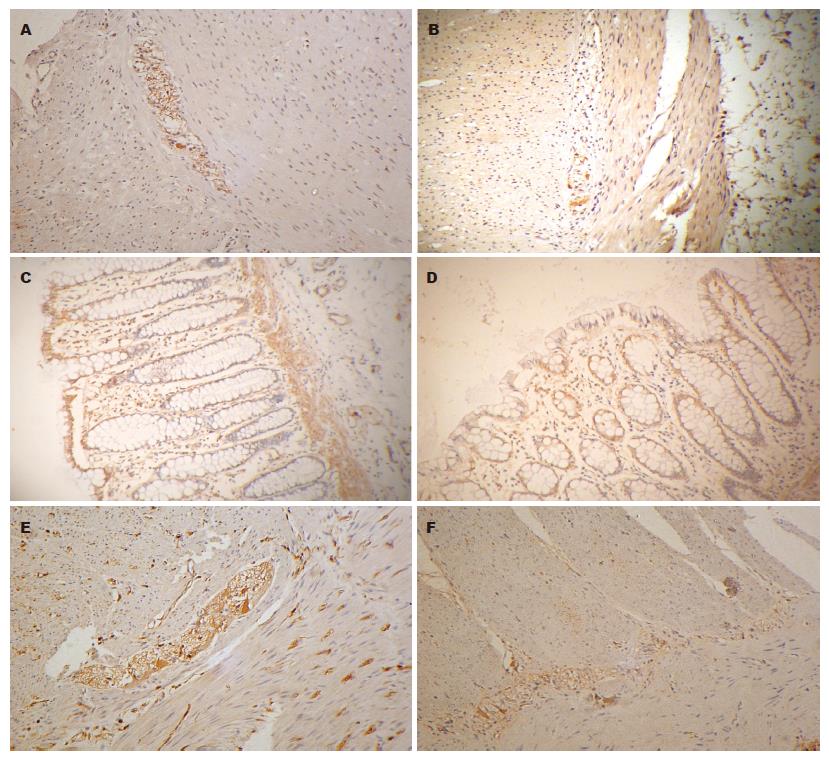
2.1.1 5-HT1A受体在结肠中的表达: 5-HT1A受体阳性染色分布于结肠黏膜下层、肌层, 其中以肌间神经丛明显. 以肌间神经丛为中心, 进行图像分析测定阳性染色指数后显示, STC组高于对照组, 分别为92.6±21.1, 83.2±14.9, 但统计学分析两组无显著性差异(P = 0.112, 表1).
2.1.2 5-HT3受体在结肠中的表达: 5-HT3受体阳性染色分布于结肠黏膜下层、肌层, 其中以肌间神经丛明显. 以肌间神经丛为中心进行图像分析后显示, STC组阳性指数显著低于对照组, 分别为65.2±15.9和94.3±20.1 (P<0.01, 表1).
2.1.3 5-HT4受体在结肠中的表达: 5-HT4受体阳性染色分布于结肠黏膜层、黏膜下层、肌层. 其中以黏膜层和肌间神经丛明显. 在黏膜层, 阳性染色主要分布于吸收性上皮细胞和部分腔面杯状细胞膜, 黏膜肌层阳性染色明显. 分别对黏膜层和肌间神经丛进行图像分析显示, STC组5-HT4受体阳性指数在黏膜层和肌间神经丛均显著低于对照组(57.8±10.9, 78.5±12.9; 77.5±19.9, 119.2±26.9, P<0.01) (图1, 表1).
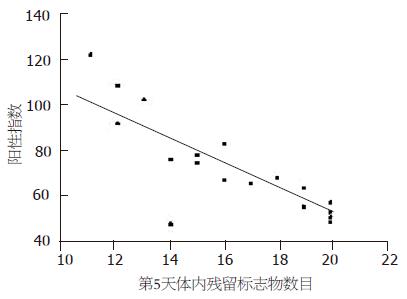
根据术前结肠传输实验结果(口服20粒不透光标志物后, 连续摄X片5 d, 观察体内残留标志物数目), 对STC组肌间神经丛5-HT3, 5-HT4受体阳性指数与结肠传输功能进行相关分析. 结果显示, 5-HT3受体表达水平与第5天体内残留标志物数量无相关性(P>0.05); 但5-HT4受体表达水平与第5天体内残留标志物数量呈负相关(r = -0.782, P<0.01, 图2).
近年来, 5-HT对肠正常动力和分泌的调控作用越来越受到关注. 肠蠕动、分泌反射的激发, 首先依赖于肠黏膜嗜铬细胞释放5-HT; 同时, 5-HT又是肠神经系统信号传递时重要的神经递质[6-8]. 愈来愈多的研究发现, 5-HT信号系统异常与胃肠道功能性疾病密切相关, 如慢性便秘、肠易激综合征、腹泻及功能性消化不良等[9-15]. 动物实验证明, 5-HT类似物能够加速结肠运动和传输, 促进黏膜上皮的分泌, 而其拮抗剂则具有明显的抑制作用[16]. 我们前期的研究发现, STC患者结肠中, 黏膜层5-HT阳性细胞显著多于正常对照组[4]. 而总5-HT受体的表达在结肠壁中呈下调趋势[5]. 然而, 5-HT对肠功能的调节依赖于不同的5-HT受体, 5-HT受体家族是神经递质受体中最复杂的家族之一, 共7个成员(5-HT1-5-HT7), 15 个亚型. 在胃肠道分布有5-HT1, 5-HT2, 5-HT3, 5-HT4, 5-HT7受体, 其功能各异[17-19]. 目前, 有关5-HT受体亚型在STC结肠中表达的研究尚鲜有报道. 由于5-HT1A, 5-HT3, 5-HT4受体的功能尤为重要、研究较为透彻, 我们遂选择这3种受体作为研究指标. 5-HT1A受体分布于肠神经元, 是少有的抑制性5-HT受体. 其主要功能为抑制快速兴奋性突触后电位, 从而抑制肠平滑肌动力. 我们的前期研究发现, 5-HT受体在STC结肠壁各层中的表达均呈下调趋势, 但在环肌层中, 5-HT受体水平越高, 结肠传输速度却越慢[5]. 提示, STC患者结肠中可能存在某些抑制性或功能变异的5-HT受体亚型的表达上调. 本研究显示, 5-HT1A受体在肠肌间神经丛及黏膜下神经丛有明显阳性染色, 黏膜上皮阴性. 在肌间神经丛, STC组的5-HT1A受体表达有高于对照组的趋势, 但两者差异无统计学意义. 因此尚不能确定STC结肠中存在5-HT1A受体的表达异常, 不排除因样本量较少等因素未能显示出这种趋势的统计学差异, 有待进一步研究. 5-HT3受体是胃肠道各5-HT受体亚型中非常重要的一种, 分布于肠神经元. 其主要作用为: (1)来源于迷走神经的肠外在感觉神经通过5-HT3受体介导, 将肠感觉信息传递至中枢神经系统. 因此, 肠神经系统向中枢神经系统的感觉传递需要5-HT3受体的介导; (2)肠肌间神经丛的5-HT3受体也负责介导中间神经元快速兴奋性电位的传递; (3)胃结肠反射由5-HT3受体介导[20-21]. 因此, 5-HT3受体一方面介导了肠感觉向中枢的传递, 另一方面也参与了肠动力的产生. 研究结果显示, 5-HT3受体主要分布于黏膜下、肌间神经丛, STC结肠中5-HT3受体阳性染色较对照组明显减少、强度降低. 提示STC结肠中存在5-HT3受体的表达下调. 因此, 一方面使肠感觉向中枢传递受到影响, 导致了临床上STC患者便意减少. 另一方面, 5-HT3受体的下调也影响了肌间神经丛5-HT传递, 影响了肠正常动力通路, 参与了便秘的发生. 5-HT4受体是胃肠道各5-HT受体亚型中研究最为深入、功能非常重要的一种. 其在胃肠道中的分布较为广泛, 肠神经元、肠平滑肌细胞、肠上皮细胞中均有发现[22]. 肠蠕动、分泌反射的激发, 即来自于肠黏膜层嗜铬细胞接受刺激后释放5-HT, 后者作用于黏膜下层神经末稍上的5-HT4和5-HT1P受体来介导完成[23-24]. 在肌间神经丛, 5-HT4受体促进胆碱能系统的神经递质释放, 导致平滑肌收缩[25]. 此外, 在一些肠平滑肌细胞上分布有5-HT4受体, 直接导致平滑肌舒张. 分布于肠黏膜上皮细胞的5-HT4受体则介导了肠分泌功能[26-28]. 本研究显示, 在STC结肠中, 5-HT4受体阳性染色在黏膜层、黏膜下神经丛、肌间神经丛及肌层等均明显减少, 强度降低. 提示STC结肠中存在5-HT4受体表达下降, 从而影响了肠蠕动、分泌反射的正常进行, 参与了STC的产生. 对5-HT4受体基因敲除大鼠的研究发现, 其结肠动力明显下降. 该大鼠结肠壁很薄, 主要为肌层变薄, 且总是较正常大鼠黏膜下和肌间神经元减少, 老年较年轻大鼠更为明显[29]. 提示长期缺乏5-HT4受体刺激可能导致结肠神经元和平滑肌萎缩. 这与我们对STC行结肠次全切除术后病理标本见到的肠壁变薄、肠神经元减少相符合. 进一步提示, 5-HT4受体表达异常可能与STC的发病密切相关. 目前, 对结肠传输功能的评估除了根据临床症状外, 主要依靠结肠传输实验. 正常人口服标志物后第5天应排出80%以上[30]. 我们对STC患者5-HT3和5-HT4受体的表达与结肠传输功能的相关分析显示, 5-HT3受体的表达与结肠传输功能未发现明显相关性, 提示两者间的关系比较复杂, 可能存在其他相关因素的影响, 尚有待进一步研究. 而5-HT4受体的表达与第5天体内残留标志物数量呈负相关, 即STC患者结肠中, 5-HT4受体表达越少, 第5天体内残留标志物越多, 提示结肠传输功能越差. 因此, 5-HT4受体的表达下降在STC的发病机制中可能具有较为重要的作用.
总之, STC患者结肠中存在5-HT3和5-HT4受体亚型的表达异常, 两者可能参与了STC的发病机制. 然而对5-HT受体亚型表达异常的产生机制, 尚有待进一步的深入研究.
由于STC的发病机制仍不清楚, 目前以长期口服泻剂对症治疗为主, 但疗效并不满意, 部分患者最终需要手术切除大部分结肠. 因此, 深入研究STC的确切发病机制, 成为目前迫切需要解决的问题.
目前, STC发病机制的研究主要集中于各种胃肠道神经递质、神经结构、Cajal细胞等方面. 已经发现多种因素与STC的发病有关. 5-HT信号系统作为肠蠕动、分泌功能的始动因素, 越来越受到重视.
近年发现, 5-HT信号系统与多种胃肠道功能性疾病密切相关. Miwa et al发现, 便秘型IBS患者结肠黏膜中, 5-HT含量显著高于腹泻型IBS和正常人. 此外, 腹泻、溃疡性结肠炎、功能性消化不良等患者结肠中也发现存在5-HT的异常
近年已有文献报道, 5-HT在STC结肠中存在表达变化, 但缺乏对5-HT信号链其他环节的进一步研究. 本文在前期工作的基础上, 继续对5-HT受体亚型展开了研究, 并探讨其意义, 国内外尚少有相关报道.
本研究发现, STC结肠中存在5-HT受体亚型的表达变化, 为STC发病机制研究提供了新的思路, 也为下一步5-HT信号系统的研究提供了基础. 同时, 也为临床应用选择性5-HT受体亚型激动剂治疗STC提供了理论依据.
本文设计内容比较新颖, 讨论较全面, 有一定的指导意义.
编辑: 王晓瑜 电编:李琪
| 1. | Kobayashi A, Yokota H, Kobayashi H, Yamataka A, Miyano T, Hayashida Y. Mucosal neuroendocrine cell abnormalities in patients with chronic constipation. Asian J Surg. 2004;27:197-201. [PubMed] |
| 2. | Bassotti G, Villanacci V. Slow transit constipation: a functional disorder becomes an enteric neuropathy. World J Gastroenterol. 2006;12:4609-4613. [PubMed] |
| 3. | Chan AO, Cheng C, Hui WM, Hu WH, Wong NY, Lam KF, Wong WM, Lai KC, Lam SK, Wong BC. Differing coping mechanisms, stress level and anorectal physiology in patients with functional constipation. World J Gastroenterol. 2005;11:5362-5366. [PubMed] |
| 4. | Zhao RH, Baig MK, Mack J, Abramson S, Woodhouse S, Wexner SD. Altered serotonin immunoreactivities in the left colon of patients with colonic inertia. Colorectal Dis. 2002;4:56-60. [PubMed] |
| 5. | Zhao RH, Baig MK, Thaler KJ, Mack J, Abramson S, Woodhouse S, Tamir H, Wexner SD. Reduced expression of serotonin receptor(s) in the left colon of patients with colonic inertia. Dis Colon Rectum. 2003;46:81-86. [PubMed] |
| 6. | De Ponti F. Pharmacology of serotonin: what a clinician should know. Gut. 2004;53:1520-1535. [PubMed] |
| 7. | Tonini M, Pace F. Drugs acting on serotonin receptors for the treatment of functional GI disorders. Dig Dis. 2006;24:59-69. [PubMed] |
| 8. | Hansen MB. The enteric nervous system II: gastrointestinal functions. Pharmacol Toxicol. 2003;92:249-257. [PubMed] |
| 10. | Miwa J, Echizen H, Matsueda K, Umeda N. Patients with constipation-predominant irritable bowel syndrome (IBS) may have elevated serotonin concentrations in colonic mucosa as compared with diarrhea-predominant patients and subjects with normal bowel habits. Digestion. 2001;63:188-194. [PubMed] |
| 11. | Baig MK, Zhao RH, Woodhouse SL, Abramson S, Weiss JJ, Nogueras JJ, Wexner SD. Variability in serotonin and enterochromaffin cells in patients with colonic inertia and idiopathic diarrhoea as compared to normal controls. Colorectal Dis. 2002;4:348-354. [PubMed] |
| 12. | Chua AS, Keeling PW, Dinan TG. Role of cholecystokinin and central serotonergic receptors in functional dyspepsia. World J Gastroenterol. 2006;12:1329-1335. [PubMed] |
| 13. | Cash BD, Chey WD. Review article: The role of serotonergic agents in the treatment of patients with primary chronic constipation. Aliment Pharmacol Ther. 2005;22:1047-1060. [PubMed] |
| 14. | Borman R. Serotonergic modulation and irritable bowel syndrome. Expert Opin Emerg Drugs. 2001;6:57-68. [PubMed] |
| 15. | Gershon MD. Nerves, reflexes, and the enteric nervous system: pathogenesis of the irritable bowel syndrome. J Clin Gastroenterol. 2005;39:S184-S193. [PubMed] |
| 16. | Grider JR, Foxx-Orenstein AE, Jin JG. 5-Hydroxytryptamine4 receptor agonists initiate the peristaltic reflex in human, rat, and guinea pig intestine. Gastroenterology. 1998;115:370-380. [PubMed] |
| 17. | Read NW, Gwee KA. The importance of 5-hydroxytryptamine receptors in the gut. Pharmacol Ther. 1994;62:159-173. [PubMed] |
| 18. | Hoyer D, Clarke DE, Fozard JR, Hartig PR, Martin GR, Mylecharane EJ, Saxena PR, Humphrey PP. International Union of Pharmacology classification of receptors for 5-hydroxytryptamine (Serotonin). Pharmacol Rev. 1994;46:157-203. [PubMed] |
| 19. | Gershon MD. Review article: serotonin receptors and transporters-roles in normal and abnormal gastrointestinal motility. Aliment Pharmacol Ther. 2004;20 Suppl 7:3-14. [PubMed] |
| 20. | Bjornsson ES, Chey WD, Ladabaum U, Woods ML, Hooper FG, Owyang C, Hasler WL. Differential 5-HT3 mediation of human gastrocolonic response and colonic peristaltic reflex. Am J Physiol. 1998;275:G498-G505. [PubMed] |
| 21. | Liu MT, Rayport S, Jiang Y, Murphy DL, Gershon MD. Expression and function of 5-HT3 receptors in the enteric neurons of mice lacking the serotonin transporter. Am J Physiol Gastrointest Liver Physiol. 2002;283:G1398-G1411. [PubMed] |
| 22. | Mader R, Kocher T, Haier J, Wieczorek G, Pfannkuche HJ, Ito M. Investigation of serotonin type 4 receptor expression in human and non-human primate gastrointestinal samples. Eur J Gastroenterol Hepatol. 2006;18:945-950. [PubMed] |
| 23. | Pan H, Gershon MD. Activation of intrinsic afferent pathways in submucosal ganglia of the guinea pig small intestine. J Neurosci. 2000;20:3295-3309. [PubMed] |
| 24. | Goyal RK, Hirano I. The enteric nervous system. N Engl J Med. 1996;334:1106-1115. [PubMed] |
| 25. | Leclere PG, Prins NH, Schuurkes JA, Lefebvre RA. 5-HT4 receptors located on cholinergic nerves in human colon circular muscle. Neurogastroenterol Motil. 2005;17:366-375. [PubMed] |
| 26. | Cooke HJ. Neurotransmitters in neuronal reflexes regulating intestinal secretion. Ann NY Acad Sci. 2000;915:77-80. [PubMed] |
| 27. | Briejer MR, Akkermans LM, Schuurkes JA. Gastrointestinal prokinetic benzamides: the pharmacology underlying stimulation of motility. Pharmacol Rev. 1995;47:631-651. [PubMed] |
| 29. | Taniyama K, Makimoto N, Furuichi A, Sakurai-Yamashita Y, Nagase Y, Kaibara M, Kanematsu T. Functions of peripheral 5-hydroxytryptamine receptors, especially 5-hydroxytryptamine4 receptor, in gastrointestinal motility. J Gastroenterol. 2000;35:575-582. [PubMed] |
| 30. | Bassotti G, de Roberto G, Castellani D, Sediari L, Morelli A. Normal aspects of colorectal motility and abnormalities in slow transit constipation. World J Gastroenterol. 2005;11:2691-2696. [PubMed] |